Hversu stuttir telómerar og bólga stuðla að sykursýki
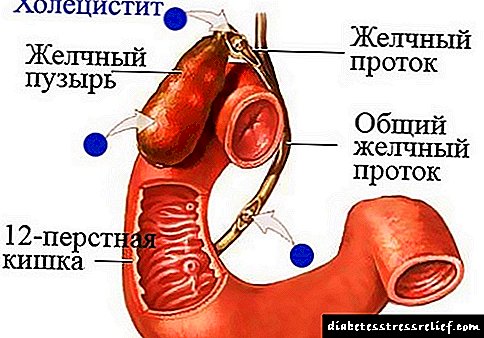
Örmynd af litningum manna með telómerum (sýnt með bleiku). (Mynd: Mary Armanios)
Telómerar eru að endurtaka DNA raðir sem vernda enda litninga. Þegar líkaminn eldist verða þeir venjulega styttri. Í þessu tilfelli missa frumurnar getu sína til að skipta sér venjulega og deyja að lokum. Stytting Telomere tengist krabbameini, lungnasjúkdómum og öðrum aldurstengdum sjúkdómum. Sykursýki, einnig tengt öldrun, hefur áhrif á einn af hverjum fjórum fullorðnum eldri en 60 ára.
Rannsókn vísindamanna við Johns Hopkins háskóla, sem birt var í tímaritinu PLoS One, er byggð á athugun frá Mary Armanios, sem vakti athygli á því að náin tengsl voru á milli tíðni sykursýki og meðfæddrar dyskeratósa (meðfæddur skyfja), sjaldgæfur arfgengur sjúkdómur sem orsakast af broti á viðhaldsbúnaðinum símanum lengdir. Oft er vart við ótímabæra gráa og snemma bilun í mörgum líffærum hjá sjúklingum með arfgengan skyfskemmd.
„Meðfædd diskeratosis er sjúkdómur sem veldur því að fólk eldist ótímabært. Við vissum að tíðni sykursýki jókst með aldrinum, svo við lögðum til að það gæti líka verið tenging milli telómera og sykursýki, “sagði í rannsókninni Armanios, dósent í krabbameinslækningum við Kimmel krabbameinsmiðstöð, Johns Hopkins háskóla.
Hjá sjúklingum með sykursýki er ekki framleitt nóg insúlín og frumur þeirra geta ekki notað það á áhrifaríkan hátt, sem leiðir til brots á reglugerð um blóðsykur.
Armanios rannsakaði mýs með stuttum telómerum og beta-frumur þeirra sem framleiða insúlín. Hún komst að því að þrátt fyrir mikinn fjölda heilbrigðra beta-frumna, var blóðsykur í þessum músum hærri og frumurnar seyttu tvö minna insúlín en í dýrum í samanburðarhópnum.
„Þetta samsvarar fyrstu stigum sykursýki hjá mönnum, þegar frumurnar eiga erfitt með að seyta insúlín sem svörun við sykri,“ útskýrir Armanios. „Í slíkum músum á mörgum stigum seytingar insúlín„Frá orkuvinnslu með hvatberum til kalsíummerkjana virka frumur á helmingi venjulegs stigs,“ segir Armanios.
Í beta-frumum músa með stuttum telómerum hafa vísindamenn uppgötvað uppbyggingu á P16 geninu sem tengist öldrun og sykursýki. Að auki breyttust mörg gen af þeim leiðum sem nauðsynleg voru til seytingu insúlíns, þar með talin leiðin sem stjórnar kalsíumerkjum. Í samanburðarhópnum fundust engar slíkar villur.
Sumar fyrri rannsóknir hafa sýnt að sjúklingar með sykursýki geta verið með stuttan telómera en eykst það sykursýki áhætta eða er afleiðing af þessum sjúkdómi, hélst óljós.
„Öldrun er stór áhættuþáttur sykursýki. Að auki gegnir arfgengi fjölskyldunnar mjög mikilvægu hlutverki. Lengd telómera er arfgengur þáttur og getur gert fólki hættara við að þróa sykursýki, “telur Armanios.
Byggt á þessari vinnu ályktar Armanios að lengd telómera geti þjónað sem lífmerki þróunar sykursýki. Í frekari rannsóknum hyggjast vísindamenn komast að því hvort mögulegt sé að spá fyrir um hættu á að þróa þennan sjúkdóm út frá lengd telómeranna. “
Hversu stuttir telómerar og bólga stuðla að sykursýki
Hversu stuttir telómerar og bólga stuðla að sykursýki
Af hverju eykur fólk með mikla kviðfitu insúlínviðnám og líkur á sykursýki? Röng næring, kyrrseta lífsstíll og streita stuðla að myndun kviðfitu og hækkun á blóðsykri. Hjá fólki með maga verða telómerar styttri með árunum <5> og líklegt er að fækkun þeirra auki insúlínviðnám. Í dönskri rannsókn þar sem 338 tvíburar tóku þátt kom í ljós að stuttir telómerar eru áreiti gegn auknu insúlínviðnámi næstu 12 ár. Hjá hverju tvíburapari sýndi annar þeirra sem voru styttri telómerar meiri insúlínviðnám <6>.
Vísindamenn hafa ítrekað sýnt fram á tengsl milli stuttra telómera og sykursýki. Stuttir telómerar auka hættu á að fá sykursýki: fólk með arfgengan stuttan telómerheilkenni er mun líklegri til að upplifa þennan sjúkdóm en aðrir íbúar. Sykursýki byrjar snemma og líður hratt. Rannsóknir á indíánum, sem af ýmsum ástæðum eru í aukinni hættu á sykursýki, gefa einnig vonbrigði. Hjá indversku með stuttar telómerar eru líkurnar á að fá sykursýki næstu fimm árin tvisvar sinnum hærri en hjá fulltrúum sama þjóðernishóps með langa telómera <7>. Metagreining á rannsóknum á samtals meira en 7.000 manns sýndi að stuttir telómerar í blóðfrumum eru áreiðanlegt merki um framtíðar sykursýki <8>.
Við þekkjum ekki aðeins fyrirkomulag þróunar sykursýki, heldur getum við jafnvel horft í brisi og séð hvað gerist í henni. Mary Armanios og samstarfsmenn sýndu að hjá músum, þegar telómerar minnka um allan líkamann (vísindamenn náðu þessu með erfðabreytingu), glata beta-frumur í brisi getu sína til að framleiða insúlín <9>. Stofnfrumur í brisi eru að eldast, telómerar þeirra eru að verða of stuttir og þeir eru ekki lengur færir um að bæta við raðir beta-frumna sem eru ábyrgir fyrir framleiðslu insúlíns og stjórnun á stigi þess. Þessar frumur deyja. Og sykursýki af tegund I fær viðskipti. Með algengari sykursýki af tegund II deyja beta-frumur ekki, en árangur þeirra er skertur. Þannig geta líka í þessu tilfelli stutt telómerar í brisi gegnt hlutverki.
Hjá öðrum sem er heilbrigður einstaklingur getur brúin frá kviðfitu yfir í sykursýki lagt gamla vinkonu okkar - langvarandi bólgu. Kviðfita stuðlar meira að þróun bólgu en til dæmis fita í mjöðmunum. Fituveffrumur seyta bólgueyðandi efni sem skemma frumur ónæmiskerfisins, sem gerir þær of snemma og vanvirða telómeru þeirra. Eins og þú manst, þá eru gamlar frumur aftur á móti samþykktar að senda stöðvunarmerki sem örva bólgu um allan líkamann - vítahringur fæst.
Ef þú ert með umfram kviðfitu, ættir þú að gæta þess að verja þig fyrir langvarandi bólgu, stuttum telómerum og efnaskiptaheilkenni. En áður en þú ferð í megrun til að losna við kviðfitu skaltu lesa þennan kafla til enda: þú gætir ákveðið að mataræðið muni bara versna. Hafðu ekki áhyggjur: við munum bjóða þér upp á aðrar leiðir til að staðla umbrot þitt.
Útdráttur af vísindalegri grein um læknisfræði og heilsugæslu, höfundur vísindalegs verks - Brailova Nataliya Vasilievna, Dudinskaya Ekaterina Nailevna, Tkacheva Olga Nikolaevna, Shestakova Marina Vladimirovna, Strazhesko Irina Dmitrievna, Akasheva Dariga Uaydinichna, Plokhova Ekaterina Vladimirovnain, Sergey Vinjina Anatolyevich
Tilgangur rannsóknarinnar var að kanna tengsl langvarandi bólgu, oxunarálags og fjölliða líffræði hjá einstaklingum með sykursýki af tegund 2 (T2DM). Efni og aðferðir. Rannsóknin náði til 50 sjúklinga með sykursýki af tegund 2 án klínískra einkenna hjarta- og æðasjúkdóma og 139 einstaklingar í samanburðarhópnum. Metið var ástand kolvetnaumbrots, stig oxunarálags (MDA malondialdehýð) og langvarandi bólgu (fíbrínógen, C-viðbrögð CRP prótein, interleukin-6 IL-6), lengd eitilfrumu-telómera og telómerasa virkni. Úrslit Hjá sjúklingum með sykursýki af tegund 2 var lengd telómerans (p = 0,031), virkni telómerasa var minni (p = 0,039) og bólgu (CRP og fíbrínógen stig) var hærra en í samanburðarhópnum. Öllum sjúklingum var skipt eftir lengd telómere. Meðal sjúklinga með T2DM, CRP og fibrinogen gildi voru hærri hjá einstaklingum með stuttan telómera (p = 0,02). Þegar hópar voru bornir saman við „langa“ telómera fannst enginn munur á stigi CRP (p = 0,93). Hjá sjúklingum með sykursýki af tegund 2 og „litla“ telómerasa virkni var alvarleiki langvarandi bólgu mestur. Hjá sjúklingum með sykursýki af tegund 2 fannst samband milli telómeralengdar og stigs CRP (r = -0,40, p = 0,004). Niðurstaða Langvinn bólga og öldrun frumna hjá sjúklingum með sykursýki af tegund 2 eru meira áberandi en við eftirlit. Hjá sjúklingum með „langa“ telómera voru einkenni langvarandi bólgu þó ekki frábrugðin þeim sem voru heilbrigðir. Kannski verja „langir“ telómerar sjúklinga með T2DM gegn skaðlegum áhrifum langvinnrar bólgu.
Lengd telómera, telómerasa virkni og aðferðir breytast hjá sjúklingum með sykursýki af tegund 2
Markmið. Til að kanna tengsl langvarandi bólgu, oxunarálagi með telómeralíffræði hjá fólki með sykursýki af tegund 2 (T2DM). Efni og aðferðir. Alls voru 50 sjúklingar með T2D og án hjarta- og æðasjúkdóma og 139 manns úr samanburðarhópi með í rannsókninni. Allir einstaklingarnir voru mældir með tilliti til umbrots kolvetna, oxunarálags (malondialdehýðs (MDA)), bólgu (C-viðbragðs próteins CRP, fibrinogen, interleukin-6), eitilfrumu telómer lengd, telomerasa virkni. Úrslit Hjá sjúklingum með sykursýki voru telómerar styttri en hjá samanburði (9,59 ± 0,54 og 9,76 ± 0,47, p = 0,031), virkni telómerasa var minni (0,47 ± 0,40 og 0,62 ± 0,36, p = 0,039), bólga (CRP, hækkuð fibrinogen) . Allir sjúklingar voru á lengd>. Í T2DM hópnum var CRP hærra hjá sjúklingum með „stutta“ telómera (7,39 ± 1,47 og 3,59 ± 0,58 mg / l, p = 0,02). Enginn marktækur munur var á magni langvarandi bólgu og oxunarálags í „löngum“ telómerum hópnum: CRP 3,59 ± 0,58 og 3,66 ± 0,50 mg / l (p = 0,93), MDA 2,81 ± 0,78 og 3,24 ± 0,78 mmól / l ( p = 0,08). Sjúklingar með sykursýki í „stuttum“ telómerum hópi voru með meiri langvarandi bólgu: CRP 7,39 ± 1,47 og 4,03 ± 0,62 mg / l (p = 0,046), jók fíbrínógen, 0,371 og 0,159 (p = 0,022). Allir sjúklingar voru með telomerasa virkni. Alvarleiki langvarandi bólgu var mestur í T2DM og „lág“ virkni telómerasa. Sambönd voru á milli lengdar símanum og CRP hjá T2DM sjúklingum (r = -0,40, p = 0,004). Ályktanir. Langvinn bólga og öldrun frumna voru meira áberandi hjá sjúklingum með T2DM. En þrátt fyrir sykursýki voru einkenni langvarandi bólgu í lágmarki hjá sjúklingum með „langa“ telómera samanborið við heilbrigt fólk. Kannski vernda langir telómerar sykursjúkir sjúklingar gegn skaðlegum áhrifum langvarandi bólgu.
Texti vísindastarfsins um viðfangsefnið „Telomere lengd, telomerasa virkni og fyrirkomulag breytinga þeirra hjá sjúklingi með sykursýki af tegund 2“
Telomere lengd, telomerasa virkni og aðferðir við breytingu þeirra hjá sjúklingi með sykursýki af tegund 2
Ph.D. N.V. BRAYLOVA1 *, Ph.D. E.N. DUDINSKAYA1, MD O.N. TKACHEVA1, samsvarandi meðlimur RAS M.V. SHESTAKOVA2, Ph.D. I.D. STRASHESKO1, frambjóðandi læknavísinda D.U. AKASHEV1, E.V. PLOKHOVA1, V.S. Pykhtina1, V.A. VYGODIN1, prófessor. S.A. FIGHTERS1
1 „Rannsóknamiðstöð ríkisins í fyrirbyggjandi lækningum“ FSBI, Moskvu, Rússlandi, 2 „Rannsóknamiðstöð innkirtlafræðinga“ FSBI í heilbrigðisráðuneyti Rússlands, Moskvu, Rússlandi
Tilgangur rannsóknarinnar var að kanna tengsl langvarandi bólgu, oxunarálags og fjölliða líffræði hjá einstaklingum með sykursýki af tegund 2 (T2DM).
Efni og aðferðir. Rannsóknin náði til 50 sjúklinga með sykursýki af tegund 2 án klínískra einkenna hjarta- og æðasjúkdóma og 139 einstaklingar í samanburðarhópnum. Metið var ástand kolvetnaumbrots, stig oxunarálags (malondialdehýðs - MDA) og langvarandi bólgu (fíbrínógen, C-viðbrögð próteins - CRP, interleukin-6 - IL-6), lengd eitilfrumu-telómera og telómerasa virkni.
Úrslit Hjá sjúklingum með sykursýki af tegund 2 var lengd telómerans (p = 0,031), virkni telómerasa var minni (p = 0,039) og bólgu (CRP og fíbrínógen stig) var hærra en í samanburðarhópnum. Öllum sjúklingum var skipt eftir lengd telómere. Meðal sjúklinga með T2DM, CRP og fibrinogen gildi voru hærri hjá einstaklingum með stuttan telómera (p = 0,02). Þegar hópar voru bornir saman við „langa“ telómera fannst enginn munur á stigi CRP (p = 0,93). Hjá sjúklingum með sykursýki af tegund 2 og „litla“ telómerasa virkni var alvarleiki langvarandi bólgu mestur. Hjá sjúklingum með sykursýki af tegund 2 fannst samband milli telómeralengdar og stigs CRP (r = -0,40, p = 0,004).
Niðurstaða Langvinn bólga og öldrun frumna hjá sjúklingum með sykursýki af tegund 2 eru meira áberandi en við eftirlit. Hjá sjúklingum með „langa“ telómera voru einkenni langvarandi bólgu þó ekki frábrugðin þeim sem voru heilbrigðir. Kannski verja „langir“ telómerar sjúklinga með T2DM gegn skaðlegum áhrifum langvinnrar bólgu.
Lykilorð: telomere lengd, telomerasa virkni, sykursýki, langvarandi bólga, oxunarálag.
Lengd telómera, telómerasa virkni og aðferðir breytast hjá sjúklingum með sykursýki af tegund 2
N.V. BRAILOVA1, E.N. DUDINSKAYA1, O.N. TKACHEVA1, M.V. SHESTAKOVA2, I.D. STRAZHESKO1, D.U. AKASHEVA1, E.V. PLOCHOVA1, V.S. PYKHTINA1, V.A. VYGODIN1, S.A. BOYTSOV1
'Rannsóknamiðstöð fyrir fyrirbyggjandi læknisfræði, Moskvu, Rússlandi, 2 rannsóknarmiðstöð fyrir innkirtlafræði, Moskvu, Rússlandi
Markmið. Til að kanna tengsl langvarandi bólgu, oxunarálagi með telómeralíffræði hjá fólki með sykursýki af tegund 2 (T2DM).
Efni og aðferðir. Alls voru 50 sjúklingar með T2D og án hjarta- og æðasjúkdóma og 139 manns úr samanburðarhópi með í rannsókninni. Allir einstaklingarnir voru mældir með tilliti til umbrots kolvetna, oxelómereres hópur: CRP 3,59 ± 0,58 og 3,66 ± 0,50 mg / l (p = 0,93), MDA 2,81 ± 0,78 og 3,24 ± 0,78 mmól / l (p = 0,08). Sjúklingar með sykursýki í „stuttum“ telómerum hópi voru með meiri langvarandi bólgu: CRP 7,39 ± 1,47 og 4,03 ± 0,62 mg / l (p = 0,046), jók fíbrínógen, 0,371 og 0,159 (p = 0,022). Allir sjúklingar voru deildir
Ályktanir. Langvinn bólga og öldrun frumna voru meira áberandi hjá sjúklingum með T2DM. En þrátt fyrir sykursýki voru einkenni langvarandi bólgu í lágmarki hjá sjúklingum með „langa“ telómera samanborið við heilbrigt fólk. Kannski vernda langir telómerar sykursjúkir sjúklingar gegn skaðlegum áhrifum langvarandi bólgu.
Lykilorð: telómeralengd, telómerasa virkni, sykursýki, langvarandi bólga, oxunarálag.
Oxunarálag og langvarandi bólga sem grunnur að líffræðilegri öldrun
Sykursýki fylgir hraðari breytingum á æðum sem gerir það að leiðandi orsök hjarta- og æðasjúkdóma og dánartíðni. Lykill gagnatengill
breytingar - blóðsykurshækkun, insúlínviðnám, uppsöfnun lokafurða af glýsingu (CNG). Hyperinsulinemia og hyperglycemia, svo og lífeðlisfræðileg öldrun, virkja ferla langvarandi bólgu og oxunarálags. Í öldrandi líkama, eins og í
lágt stig sjúklings með sykursýki, stig ýmissa merkja bólgu eykur C-hvarfgjarnt prótein (CRP), IL-18, TNF-a („bólgandi“), eykur virkni fituperoxíðunar með myndun malondialdehýðs (MDA) og viðbragðs súrefnis tegunda (ROS) . Allt þetta leiðir til skertrar próteinsmyndunar, frumudrepandi frumna og þróunar á hrörnunarferlum.
Líffræði telómera hjá einstaklingum með sykursýki af tegund 2
Ein af ástæðunum fyrir mismunandi tíðni öldrunar í æðum hjá sjúklingum með sykursýki af tegund 2 er upphaflega „erfðavarnir“ frá útsetningu fyrir utanaðkomandi þáttum. Telomere lengd og telomerasa virkni getur krafist hlutverks erfðamerkja á líffræðilegum aldri æðanna. Telómerar eru lokahlutar línulegrar DNA sameindar sem smám saman er styttur með hverri frumuskiptingu. Um leið og lengd síms DNA er hættulega lágt, er P53 / P21, af völdum öldrunar frumunnar, viðhaldið umbrotsvirkni þess. Vísbendingar eru um að lengd telómera í hvítfrumum endurspegli lengd telómera í stofnfrumum og samsvari lengd þeirra í frumufrumum í æðaæxlum, sem gerir okkur kleift að líta á þessa færibreytu sem lífmerk fyrir öldrun æða. Fyrstu ábendingar um styttingu telómerna hjá einstaklingum með sykursýki af tegund 2 og skert glúkósaþol voru fengnar. Stytting á telómerum getur tengst þróun T2DM, CVD og öldrunar í æðum.
Önnur erfðamerki á líffræðilegum aldri getur verið telómerasavirkni. Telómerasa er ensím sem bætir sérstökum endurteknum DNA röð við 3'-endann á DNA keðjunni og felur í sér telómerasa andstæða transkriptasa (TERT) og telómerasa RNA (TERC). Í flestum sómatískum frumum er virkni telómerasa nokkuð lítil. Þrátt fyrir að telómerasa gegni ekki mikilvægu hlutverki í stöðvunarstöðvum í telomere lengd í ellinni, er talið að þetta ensím hafi mikilvægar aðgerðir sem ekki eru telómerar til að draga úr apoptosis, stjórna frumufjölgun og hvatbera virkni í frumum manna.
Hlutverk langvarandi bólgu og oxunar
streitu í breytingum á lengd og virkni símsvara
telómerasa hjá einstaklingum með sykursýki af tegund 2
Helstu afköst sjúklegra ferla í tengslum við öldrun á frumustigi eru talin oxunarálag og langvarandi bólga, sem veldur styttingu DNA án endurtekningar. Telomere viðkvæm
Þeir bera ábyrgð á oxun á DNA sameindinni. ROS in vitro dregur úr innihaldi hTERT kjarnapróteins í æðaþelsfrumum og í samræmi við það telómerasa virkni. Telómerasa getur verndað hvít blóðkorn frá oxunarálagi án þess að hafa áhrif á lengd telómera. Aukin bólguvirkni flýtir fyrir styttingu telómera bæði vegna virkjunar á margföldun frumna og vegna losunar ROS. Stigvaxandi stytting telómera með aukningu á T2DM lengd getur verið tengd langvinnri bólgu og oxunarálagi. Samband milli telomerasa virkni og langvarandi bólgu er blandað. Langvinn bólga á frumstigi í gegnum ýmsa merkjaslóða (sem felur í sér NF-kB, prótein kinase C eða Akt kinase) með fosfórýleringu eða umritun hTERT getur virkjað telómerasa, sem,
Upplýsingar um höfundana:
Brailova Natalia Vasilievna - Ph.D. Dep.rannsókn á öldrun og forvörnum gegn aldurstengdum sjúkdómum Rannsóknamiðstöðvar ríkisins í forvarnarlækningum, Moskvu, Rússlandi, tölvupóstur: [email protected],
Dudinskaya Ekaterina Nailevna - frambjóðandi í læknavísindum, yfirfræðimaður Dep. rannsókn á öldrun og forvörnum gegn aldurstengdum sjúkdómum hjá fjárlagastofnun sambandsríkisins „Rannsóknamiðstöð ríkisins í fyrirbyggjandi lækningum“, Moskvu, Rússlandi,
Tkacheva Olga Nikolaevna - MD, prófessor, hendur. Dep. að rannsaka öldrun og forvarnir gegn aldurstengdum sjúkdómum FSBI State Research Center for Prevent Medicine, Moskva, Rússlandi, Shestakova Marina Vladimirovna - samsvarandi meðlimur. RAS, forstöðumaður stofnunarinnar um sykursýki, staðgengill dádýr Vísindastörf fjárlagastofnunar alríkisstofnunarinnar „Endocrinological Scientific Center“, Moskvu, Rússlandi, Strazhesko Irina Dmitrievna - frambjóðandi læknavísinda, yfirrannsakandi Dep. rannsókn á öldrun og forvörnum gegn aldurstengdum sjúkdómum hjá fjárlagastofnun sambandsríkisins „Rannsóknamiðstöð ríkisins í fyrirbyggjandi lækningum“, Moskvu, Rússlandi,
Akasheva Dariga Uaydinichna - frambjóðandi læknavísinda, yfirrannsakandi Dep. rannsókn á öldrun og forvörnum gegn aldurstengdum sjúkdómum hjá fjárlagastofnun sambandsríkisins „Rannsóknamiðstöð ríkisins í fyrirbyggjandi lækningum“, Moskvu, Rússlandi,
Plokhova Ekaterina Vladimirovna - frambjóðandi í læknavísindum, eldri rannsóknir Dep. rannsókn á öldrun og forvörnum gegn aldurstengdum sjúkdómum hjá fjárlagastofnun sambandsríkisins „Rannsóknamiðstöð ríkisins í fyrirbyggjandi lækningum“, Moskvu, Rússlandi,
Pykhtina Valentina Sergeevna - rannsóknarstofa. Dep. rannsókn á öldrun og forvörnum gegn aldurstengdum sjúkdómum hjá fjárlagastofnun sambandsríkisins „Rannsóknamiðstöð ríkisins í fyrirbyggjandi lækningum“, Moskvu, Rússlandi,
Vygodin Vladimir Anatolyevich - eldri rannsóknir rannsóknarstofu. Líffræðistofnun Fjárlagastofnun ríkisstjórnarinnar „Rannsóknamiðstöð fyrir fyrirbyggjandi lyf“, Moskvu, Rússlandi, Sergey Anatolyevich Boytsov - MD, prófessor, hendur. Dep. Hjartalækningar og sameinda erfðafræði, forstöðumaður, Rannsóknamiðstöð ríkisins í fyrirbyggjandi lækningum, Moskvu, Rússlandi
Píanó, bætir upp fyrir hraðari styttingu líkamsráðstafana. En á síðari stigum hægrar bólgu minnkar virkni telómerasa, sem leiðir til styttingar á telómerum.
Markmið rannsóknarinnar var að kanna tengsl langvarandi bólgu og oxunarálags við telómeralíffræði hjá einstaklingum með sykursýki af tegund 2.
Efni og aðferðir
Rannsókn í einu stigi tók til sjúklinga með sykursýki af tegund 2 sem fóru í göngudeildarskoðun í vísindarannsóknamiðstöð alríkislögreglunnar fyrir skurðaðgerðir 2012-2013. Aðalhópurinn samanstóð af sjúklingum á aldrinum 45 til 75 ára með sjúkdómslengd ekki lengur en 12 mánuði og HbA1c innihald 6,5 til 9,0%. Í samanburðarhópnum voru einstaklingar án T2DM sem höfðu ekki klínísk einkenni CVD, sem sneru sér til miðstöðvar fyrirbyggjandi ráðgjafar.
Útilokunarviðmið: sykursýki af tegund 1 og aðrar sértækar tegundir sykursýki, slagæðaháþrýstingur af 3. stigi (háþrýstingur) (blóðþrýstingur> 180/100 mm Hg), reglulega notkun blóðþrýstingslækkandi lyfja, reglulega notkun blóðþrýstingslækkandi lyfja, alvarlegir sykursýkisjúkdómar (fyrirfram dreifiefni og fjölgandi sjónukvilla af völdum sykursýki, langvinn nýrnasjúkdómur á stigum 3b, 4 og 5), hjartabilun (langvarandi hjartabilun, stig II - IV (NYHA), valvular hjartasjúkdómur), langvarandi lifrarbilun, krabbamein, meðganga, brjóstagjöf.
Allir sjúklingar undirrituðu upplýst samþykki til að taka þátt í rannsókninni. Rannsóknarreglan var samþykkt af siðanefnd FSBI GNITsPM heilbrigðisráðuneytisins í Rússlandi. Bókun fundar LEK nr. 8 frá 11.29.11.
Á skimunarstiginu fóru allir sjúklingar í staðlaða klíníska skoðun: söguþróun, klínísk skoðun, þ.mt mæling á líkamsþyngd og hæð með útreikningi á líkamsþyngdarstuðli (BMI), mæling á slagbils (SBP) og þanbilsþrýstingi (DBP) á kvarðað tæki með því að nota herðakúffu (HEM-7200 M3, Omron Healthcare, Japan). Blóðþrýstingur var mældur eftir 10 mínútna hvíld á hægri handlegg í sitjandi stöðu 3 sinnum eftir 2 mínútur, meðaltal þriggja mælinga var með í greiningunni. Blóð var tekið til rannsóknarstofuprófa (klínískt og lífefnafræðilegt), hjartalínuriti var skráð og líkamsræktarpróf var framkvæmt á hlaupabrettaprófinu með því að nota BRUCE siðareglur (Intertrack, SCHILLER). Af 250 sjúklingum sem voru skoðaðir uppfylltu 189 skilyrði um aðgreiningar. Ástand kolvetnaumbrots var metið í þeim öllum, telómeralengd og virkni telómerasa voru ákvörðuð og alvarleiki oxunarálags og langvarandi bólgu var skráður.
Kolvetnisumbrot
Styrkur glúkósa í plasma var ákvarðaður með glúkósaoxíðasa aðferðinni á SAPPHIRE-400 greiningartæki með því að nota DiaSys greiningarsett. HbA1c stigið var skráð með fljótandi litskiljun á Sapphire 400 greiningartæki (Niigata Mechatronics, Japan) í samræmi við venjulega aðferð framleiðanda.
Telomere lengdarmæling
Mælingin á hlutfallslegri lengd telómeranna á útlægum eitilfrumum var framkvæmd á DNA í erfðamengi. Við rauntíma PCR greiningu var magn DNA með sermisröð í erfðamenginu metið. Samhliða var PCR í rauntíma framkvæmt á einu afriti af erfðafræðilega DNAinu. Við héldum út frá meðalhóf hlutfallsins á magni af telómeríum og stökum eintökum og símslengdinni.
Mæling á telomerasa virkni
Til að ákvarða telomerasa virkni var notuð tækni með nokkrum breytingum. Virkni ensímsins var rannsökuð í völdum einfrumugildum blóðfrumna (u.þ.b. 10.000 frumur í hverri greiningu). Einfrumufrumur voru lýsaðar með vægum þvottaefnahausum, aðskilin útdráttinn. Telómerasa fjölliðunarviðbrögð voru framkvæmd með útdrættinum; afurðirnar sem fengust voru magnaðar með rauntíma PCR. Magn símsvörunarafurða er í réttu hlutfalli við fjölliðavirkni (Mastercycler magnari (Eppendorf, Þýskaland).
Oxun álagsálags
Til að meta alvarleika oxunarálags var styrkur MDA rannsakaður með aðferðinni við luminol-háð lyfjahækkun í heilblóði.
Mat á langvinnri bólgu
Til að meta alvarleika langvarandi bólgu skoðuðum við styrk fíbrínógen, mjög viðkvæmt C-viðbragðs prótein (CRP) (ónæmisbælingaraðferð með SAPPHIRE-400 greini), IL-6 (ónæmisensímaðferð).
Fylgni lífeðlisfræðinnar
Rannsóknin var framkvæmd í samræmi við góða staðla um klíníska starfshætti og meginreglur Helsinki-yfirlýsingarinnar. Rannsóknarreglan var samþykkt af siðanefndum allra klínískra miðstöðva sem tóku þátt. Áður en það var tekið þátt í rannsókninni
Allir þátttakendur fengu skriflegt upplýst samþykki.
Við notuðum pakka af notuðum tölfræðiforritum SAS 9.1 (Statistical Analysis System, SAS Institute Inc., USA). Öll gögn voru færð inn í örgjörva í töflu, en eftir það var gerð könnunargreining til að bera kennsl á innsláttarvillur og vantar gildi. Fyrir megindlegar breytur voru notaðir ósamhverfar prófanir og kurtosis sem leiddi í ljós eðlilega dreifingu flestra breytna. Tölulegar upplýsingar eru kynntar sem meðalgildi og staðalfrávik (M ± SD). Meðalgildum klínískra breytna var borið saman í tveimur hópum með því að nota samtímis greiningu á stöðugum breytum og x2 viðmiðun fyrir flokkalegar breytur. Að því er varðar tíðnivísar var breytt viðmið nemanda notuð með hliðsjón af umbreytingu Fcsher arcsin. Til að bera kennsl á mælingu á línulegu sambandi milli breytanna var fylgigreining (Spearman rank correlations) framkvæmd. Til að meta sjálfstæð tengsl milli breytanna voru notaðir fjölvíddar aðhvarfsjöfnur og margfeldi línuleg aðhvarfsgreining. Eftir að hafa mælt lengd telómeranna var viðbótarskipting sjúklinga í röðum framkvæmd eftir því hvaða færibreytugildi voru. Í fyrsta sæti hópsins voru sjúklingar með mjög stutta telómeralengd: frá lágmarksgildi í almenna hópnum að mörk fyrsta fjórðungsins (þ.e.a.s. undir 25% af dreifimörkum). Í annarri röð hópsins voru sjúklingar með telómeralengd frá miðgildi dreifingar til lægri fjórðunga. Í þriðja stigshópnum voru sjúklingar með telómeralengd frá miðgildisdreifingu í 75% af dreifimörkum. Einstaklingum með mjög stóra símanalengd, sem samanstendur af efri fjórðungi dreifingarinnar, var úthlutað í fjórða sæti hópsins. Núlltilgátunni var hafnað á p i Get ég ekki fundið það sem þú þarft? Prófaðu bókmenntavalið.
Alls voru 189 sjúklingar (64 karlar og 125 konur) með í rannsókninni sem voru sameinaðir í tvo hópa: með T2DM (i = 50) og án sykursýki (i = 139). Lengd T2DM var 0,9 + 0,089 ár. Meðalaldur sjúklinga með sykursýki af tegund 2 var 58,4 ± 7,9 ár og samanburðarhópurinn - 57,45 + 8,14 ár (p = 0,48). Í SD2 hópnum var SBP 131,76 + 14,7 mm Hg, og í samanburðarhópnum - 127,78 + 16,5 mm Hg. (p = 0,13). MDA stig í T2DM hópnum var 3.193 + 0,98 μmól / L, og í samanburðarhópnum var það 3.195 + 0,82 μmól / L (p = 0,98). Meðalstig IL-6 í T2DM hópnum var 3,37 + 1,14 pg / ml, í samanburðarhópnum var það 5,07 + 0,87 pg / ml (p = 0,27).
Í hópnum með sykursýki var hlutfall karla hærra en í hópi heilbrigðra einstaklinga (46% á móti 29%) (p = 0,013). Karl / kvenhlutfall í T2DM hópnum var 46/54% á móti 29/71% í samanburðarhópnum (^ = 0.013). Vísitala BMI sjúklinga með sykursýki af tegund 2 var marktækt hærri en hjá heilbrigðum einstaklingum: 30,28 ± 5,42 á móti 27,68 ± 4,60 kg / m2 (p = 0,002). DBP í T2DM hópnum var 83,02 ± 11,3 mm Hg. á móti 78,6 ± 9,3 mmHg í samanburðarhópnum (p = 0,015). Hjá sjúklingum með sykursýki af tegund 2 var lengd eitilfrumu-telómera marktækt styttri (p = 0,031) og virkni telómerasa var marktækt minni (p = 0,039) en hjá heilbrigðum einstaklingum. Í T2DM hópnum voru fastandi plasma glúkósa (GPN) og HbA1c gildi verulega hærri en í samanburðarhópnum (p i Get ekki fundið það sem þú þarft? Prófaðu val á bókmenntum.
mer 9,59 + 0,54 9,76 + 0,47 0,031
Telomerasa virkni 0,47 + 0,40 0,62 + 0,36 0,039
MDA, μmól / L 3,19 + 0,98 3,20 + 0,82 0,98
IL-6, pg / ml 3,37 + 1,14 5,07 + 0,87 0,27
CRP, mg / L 6,34 + 1,06 3,82 + 0,41 0,031
Fíbrínógen, g / l 3,57 + 0,87 3,41 + 0,54 0,23
fíbrínógen 0,30 + 0,04 0,11 + 0,03 0,004
Tafla 2. Vísbendingar um umbrot kolvetna, oxunarálag, langvarandi bólgu, lengd telómera og telómerasa virkni, allt eftir tilvist T2DM
SD2 + ("= 50) ___ SD2- (" = 139)
Breytur langar líkamsstærðir ("= 15) stuttar líkamsstærðir (" = 35) P langar líkamsstærðir ("= 76) stuttar líkamsstærðir (" = 63) P
HbA1c,% 11,54 + 3,57 13,48 + 3,24 0,072 10,98 + 1,83 11,59 + 2,03 0,075
GPN, mmól / L 0,83 + 0,13 0,95 + 0,17 0,02 0,76 + 0,16 0,78 + 0,14 0,59
MDA, μmól / L 2,81 + 0,78 3,35 + 1,04 0,09 3,24 + 0,78 3,14 + 0,87 0,58
CRP, mg / L 3,59 + 0,58 7,39 + 1,47 0,02 3,66 + 0,50 4,07 + 0,68 0,63
Fíbrínógen, g / l 3,39 + 0,55 3,70 + 0,91 0,15 3,38 + 0,53 3,44 + 0,55 0,50
Tilvist aukins fíbrínógen 0,133 0,371 0,09 0,069 0,159 0,09
IL-6, pg / ml 5,95 + 3,89 2,43 + 0,51 0,39 5,70 + 1,31 4,41 + 1,08 0,45
Telomerasa virkni 0,51 + 0,09 0,47 + 0,08 0,78 0,60 + 0,05 0,66 + 0,07 0,42
„Lág“ telómerasa virkni 0,417 0,710 0,09 0,512 0,474 0,73
Tafla 3. Vísbendingar um oxunarálag, langvarandi bólgu og telomerasa virkni eftir hlutfallslegri lengd telómeranna
Long telomeres Short telomeres
Parameter SD2 + ("= 15) SD2- (" = 76) P SD2 + ("= 35) SD2- (" = 63) P
MDA, μmól / L 2,81 + 0,78 3,24 + 0,78 0,08 3,35 + 1,04 3,14 + 0,87 0,35
CRP, mg / L 3,59 + 0,58 3,66 + 0,50 0,93 7,39 + 1,47 4,03 + 0,62 0,046
Fíbrínógen, g / l 3,39 + 0,55 3,38 + 0,53 0,95 3,70 + 0,91 3,44 + 0,55 0,155
Tilvist aukins fíbrínógen 0,133 0,069 0,40 0,371 0,159 0,022
IL-6, pg / ml 5,94 + 3,89 5,70 + 1,31 0,94 2,43 + 0,51 4,41 + 1,08 0,10
Telomerasa virkni 0,51 + 0,09 0,60 + 0,05 0,36 0,47 + 0,08 0,62 + 0,07 0,063
„Lág“ telómerasa virkni 0,512 0,417 0,56 0,710 0,474 0,049
Tafla 4. Vísbendingar um umbrot kolvetna, oxunarálag, langvarandi bólgu, lengd telómera og telómerasa virkni (AT), allt eftir nærveru T2DM
Parameter SD2 + SD2- R
hár AT lágt AT P hátt AT lágt AT
HbA1c,% 7,19 + 0,60 7,36 + 0,80 0,45 5,19 + 0,58 5,35 + 0,41 0,16
GPN, mmól / L 7,55 + 1,40 8,47 + 1,79 0,09 5,17 + 0,51 5,33 + 0,44 0,14
MDA, μmól / L 2,93 + 0,90 3,23 + 1,01 0,34 3,06 + 0,93 3,34 + 0,72 0,25
IL-6, pg / ml 2,98 + 1,01 3,91 + 2,03 0,68 3,77 + 1,00 6,37 + 1,80 0,21
CRP, mg / L 5,34 + 1,40 7,12 + 1,76 0,43 4,14 + 0,78 2,55 + 0,26 0,06
Fíbrínógen, g / l 3,62 + 0,70 3,66 + 0,85 0,87 3,60 + 0,50 3,37 + 0,43 0,034
Tilvist aukins fíbrínógen 0.375 0.259 0.43 0,205 0,075 0,09
Hlutfallsleg sími lengd 9,77 + 0,50 9,43 + 0,42 0,02 9,81 + 0,51 9,70 + 0,45 0,33
heilbrigðir sjúklingar milli einstaklinga með „stutta“ og „langa“ telómera, var enginn marktækur munur hvað varðar umbrot kolvetna, alvarleika oxunarálags og langvarandi bólgu (tafla 2).
Hjá sjúklingum með T2DM og „stutta“ telómera var stig CRP marktækt hærra og aukið fibrinogen algengara. Mismunur á stigum MDA, fibrinogen, IL-6 fannst ekki. Telomerasa virkni var aðeins minni hjá sjúklingum með sykursýki af tegund 2 og stuttum telómerum (9 = 0,063). „Lág“ vísbendingar um telómerasa virkni fundust hjá sjúklingum með T2DM og „stuttur“ líkami mælist marktækt oftar (9 = 0,049).
Hjá einstaklingum með langa telómera voru merki um langvarandi bólgu og oxunarálag, svo og telómerasa virkni, nánast óháð tilvist T2DM (tafla 3).
Miðgildi telomerasa virkni var 0,50. Öllum sjúklingum með lægra gildi þessa vísis var úthlutað í hópinn „lág“ telómerasa virkni, og þeir sem hafa telómerasa virkni umfram þetta gildi, voru í hópinn „mikla“ telómerasa virkni. Hjá sjúklingum með sykursýki af tegund 2 var ástand kolvetnisumbrots, virkni merkja oxunarálags og langvarandi bólgu ekki mismunandi á milli þessara hópa, að undanskildum styttri telómerum í hópnum með „lága“
telómerasa (p = 0,02). Viðmiðunarhópurinn leiddi heldur ekki í ljós háð magn oxunarálags, CRP og IL-6 af telómerasa virkni, einstaklingar með „mikla“ telómerasa virkni sýndu hærra fíbrínógen gildi (tafla 4).
Hjá sjúklingum með T2DM og „lága“ telómerasa virkni var CRP hærra, aukið fibrinogen var algengara og lengd telómerans var styttri. Magn IL-6, MDA og fíbrínógen í hópnum með „litla“ telómerasa virkni var ekki háð tilvist T2DM. Í hópnum „mikil“ telómerasa virkni voru andlit með T2DM + og T2DM ekki frábrugðin hvað varðar oxunarálag, langvarandi bólgu og lengd telómera (tafla 5).
Hjá sjúklingum með T2DM fundust tengsl milli hlutfallslegs lengdar telómera og GPN, CRP, „lítils“ telómerasa virkni, en engin fylgni fannst við aldur, blóðþrýsting, BMI, HLA1c MDA, fíbrínógen og IL-6 (tafla 6).
Í CD2 + hópnum fannst jákvæð fylgni eingöngu milli telómerasa virkni og mjög langrar telómeralengdar. Í samanburðarhópnum var virkni telómerasa jákvæð tengd SBP, DBP, CRP og fibrinogen stigum (tafla 7).
Í kjölfarið var gerð margþætt línuleg aðhvarfsgreining þar sem hlutfallsleg lengd telómeranna var notuð sem háð breytu og aldur, GPN, CRP og „lág“ telómerasa virkni voru notuð sem sjálfstæðar breytur. Það kom í ljós að aðeins GPN og CRP eru óháð tengslum við telómer lengd (tafla 8).
Þegar telómerasavirkni var notuð sem háð breytu og sem sjálfstæðir - aldur, DBP, GPN, CRP, fíbrínógen, kom í ljós að í CD2 hópnum voru aðeins DBP (endurgjöf) og fíbrínógen (bein tenging) tengd óháð telómerasa virkni ( tafla 9). Í CD2 + hópnum voru engin sjálfstæð tengsl milli rannsakaða breytanna og telómerasa virkni (tafla 10).
Við fundum að hjá sjúklingum með sykursýki af tegund 2 er lengd líkamsráðstafana að meðaltali styttri en hjá heilbrigðu fólki. Það er það
Tafla 6. Samhengi á hlutfallslegri telómeralengd við aðrar breytur í rannsóknarhópunum (Spearman rank correlations)
SD2 + (n = 50) SD2- (n = 139) telómer lengd telómer lengd
Aldur, ár -0,09, p = 0,52 -0,18, p = 0,035
GARDEN, mmHg -0,036, p = 0,81 -0,14 p = 0,09
DBP, mmHg 0,066, p = 0,65 -0,03 p = 0,75
BMI, kg / m2 -0,025, p = 0,87 -0,13 p = 0,13
GPN, mmól / L -0,42, p = 0,0027 -0,16 p = 0,05
HbA1c,% -0,23, p = 0,12 -0,03 p = 0,69
MDA, μmól / L -0,17, p = 0,24 0,07, p = 0,55
CRP, mg / L -0,40, p = 0,004 -0,05 p = 0,57
Fíbrínógen, g / l -0,18, p = 0,22 -0,04 p = 0,65
IL-6, pg / ml -0,034, p = 0,82 -0,04 p = 0,68
Telomerasa virkni 0,15, p = 0,33 0,03, p = 0,78
„Lág“ líkamsstarfsemi
merasa -0,32, p = 0,035 -0,06, p = 0,61
Tafla 7. Tenging telómerasa virkni við aðrar breytur í hópunum sem rannsakaðir voru (Spearman rank correlations)
Virkni telomerasa SD2 + (n = 50) SD2- (n = 139)
Aldur, ár GARDEN, mm Hg DBP, mmHg BMI, kg / m2 GPN, mmól / L НАА1с,% MDA, μmol / L SRB, mg / L
Tilvist aukins CRP Fibrinogen, g / l IL-6, PG / ml
Hlutfallsleg lengd líkamsráðstafana
Mjög langar líkamsráðstafanir
5, p = 0,35 2, p = 0,44 4, p = 0,37 -0,07, p = 0,65 -014, p = 0,38 -0,08, p = 0,64 - 0,064, p = 0,69 0,056, p = 0,73 0,03, p = 0,89-0,086, p = 0,59-0,006, p = 0,97
0,07, p = 0,52 0,20, p = 0,08 0,33, p = 0,003
-0,04 -0,17 -0,08 -0,11
p = 0,72 p = 0,14 p = 0,47 p = 0,47
0,11, p = 0,35 0,35, p = 0,002 0,28, p = 0,01 -0,19, p = 0,12
0,15, p = 0,33 0,03, p = 0,78 0,40, p = 0,0095 0,14, p = 0,22
í samræmi við niðurstöður annarra höfunda. Í rannsókn sem M. Sampson o.fl. engin tengsl fundust milli styttingar á lengd eitilfrumu-telómera og vísbendinga um umbrot kolvetna (hugsanlega vegna lítillar fjölda
Tafla 5. Vísbendingar um oxunarálag, langvarandi bólgu og hlutfallslegan lengd telómera eftir verkun telómerasa (AT)
Parameter Low AT High AT
SD2 + SD2- r SD2 + SD2- r
MDA, μmól / L 3,23 + 1,01 3,34 + 0,72 0,68 2,93 + 0,90 3,06 + 0,93 0,68
IL-6, pg / ml 3,91 + 2,03 6,37 + 1,80 0,37 2,98 + 1,01 3,77 + 1,00 0,62
CRP, mg / L 7,12 + 1,76 2,55 + 0,26 0,016 5,34 + 1,40 4,14 + 0,78 0,44
Fíbrínógen, g / l 3,66 + 0,85 3,37 + 0,43 0,11 3,62 + 0,70 3,60 + 0,50 0,90
Tilvist aukinnar fíbrínógen 0,259 0,075 0,043 0,375 0,205 0,21
Hlutfallsleg sími lengd 9,43 + 0,42 9,70 + 0,45 0,016 9,77 + 0,50 9,81 + 0,51 0,80
Tafla 8. Háð lengd telómera eftir aldri, GPN, CRP, minnkað telómerasa virkni sem sjálfstæðar breytur hjá sjúklingum með sykursýki af tegund 2
Færibreyta B Hefðbundin villa P
Aldur, ár -0.0008 -0.008 0,92
GPN, mmól / L -0,076 0,036 0,004
CRP, mg / L -0.018 0,007 0,020
„Lág“ telóm virkni
sinnum -0.2010 0.125 0.116
Tafla 9. Háð telomerasa virkni á aldri, DBP, GPN, CRP, fibrinogen, GPN sem óháðar breytur í samanburðarhópnum
Færibreyta B Hefðbundin villa P
Aldur, ár -0.003 0,005 0,534
DBP, mmHg -0,010 0,004 0,012
GPN, mmól / L -0,105 0,081 0,20
CRP, mg / L 0,019 0,010 0,073
Fíbrínógen, g / l 0,205 0,080 0,013
Tafla 10. Háð telómerasa virkni á aldri, DBP, GPN, CRP, fibrinogen, GPN sem sjálfstæðar breytur í hópi sjúklinga með sykursýki af tegund 2
Færibreyta B Hefðbundin villa P
Aldur, ár 0,002 0,008 0,74
DBP, mmHg -0.0001 0,006 0,98
GPN, mmól / L -0,006 0,039 0,15
CRP, mg / L 0,007 0,009 0,45
Fíbrínógen, g / l -0,009 0,089 0,91
STI hópur). Rannsókn okkar leiddi í ljós marktækan mun á HbA1c og GPN hjá sjúklingum með T2DM með „langa“ og „stutta“ telómera og fundu einnig neikvæð tengsl milli lengdar telómeranna og GPN. Það er hægt að halda því fram að hjá sjúklingum með sykursýki af tegund 2 séu styttri telómerar tengdir lélegri stjórn á sykursýki og blóðsykurshækkun geti aftur á móti haft skaðleg áhrif á eftirmyndandi öldrun.
Við fundum að virkni telómerasa hjá sjúklingum með sykursýki af tegund 2 er minni en hjá heilbrigðu fólki, sem er í samræmi við fáar upplýsingar sem til eru. Hlutverk telómerasa við venjulega öldrun er óljós og ekki nægjanlega rannsakað. Við höfum ekki leitt í ljós tengsl milli virkni telómerasa og lengdar telómeru, sem er í samræmi við þá skoðun að hlutverk telómerasa sé óverulegt við að viðhalda stöðvun telómeralengdar í ellinni.
Skaðleg áhrif blóðsykurshækkunar á líffræði telómera, þ.mt í æðaþelsfrumum, verða að veruleika með oxunarálagi og langvinnri bólgu. Hins vegar verulegur
Enginn munur var á stigi MDA milli hópa T2DM + og T2DM (líklega vegna skamms tíma sykursýki og skorts á alvarlegri langvinnri blóðsykurshækkun, þar sem blóðsykursfall í langan tíma tengist þróun verulegs og viðvarandi oxunarálags). Nauðsynlegt getur verið að nota nákvæmari vísbendingar um oxunarálag, svo sem útskilnað á þvagi 8-iso-prostaglandin F2a. Við fundum hærra magn bólgueyðandi lyfja hjá sjúklingum með sykursýki af tegund 2 en hjá einstaklingum í samanburðarhópnum. Annar bólgueyðandi, IL-6, eins og það kom í ljós nýlega, hefur margvísleg áhrif, ekki aðeins cýtókín, heldur einnig mýokín, örvar vöðvamyndun og hefur áhrif á umbrot orku. Kannski var það ástæða þess að stig IL-6 í stjórninni reyndist vera eitthvað hærra, sem þó þarfnast frekari rannsókna.
Langvinn bólga leiðir til ótímabærrar öldrunar frumna, styttir telómeru með því að virkja útbreiðslu eitilfrumna og virkja losun ROS, sem veldur oxunartjóni á endahluta DNA. Árið 2012 var sýnt fram á að smám saman stytting telómera með aukningu á T2DM lengd gæti tengst samhliða aukningu á oxunarálagi og langvinnri bólgu. Niðurstöður okkar eru í samræmi við gögn frá fyrri rannsóknum. Við fundum hærra magn CRP og aðeins hærra stig MDA hjá sjúklingum með sykursýki af tegund 2 og stuttum telómerum en hjá sjúklingum með langa telómera. Neikvætt samband var milli lengdar eitilfrumu-telómeru og klassísks merkis fyrir langvarandi bólgu - CRP, sem bendir til þátttöku langvarandi bólgu í styttingu telómere hjá sjúklingum með sykursýki af tegund 2. Í samanburðarhópnum voru engin tengsl milli CRP og símslengd, sem er í samræmi við niðurstöður annarra rannsókna. Skortur á samskiptum milli IL-6, fibrinogen og telomere lengd í báðum hópum er hægt að skýra með litlum breytileika þessara vísa. Þar að auki, með því að treysta aðeins á magn cýtókína í blóðrás, getur maður vanmetið gráðu staðbundinnar bólgu í vefjum.
Upplýsingar um bókmenntir um tengsl langvarandi bólgu og telomerasa virkni eru misvísandi. Langvarandi bólga leiðir til tæmingar á telómerasa, sem við sáum hjá sjúklingum með sykursýki af tegund 2. Með minni áberandi og minni langvarandi bólgu, eins og á við um efnaskiptaheilkenni eða miðlungsmikla æðakölkun, þvert á móti, þá er aukning á virkni telómerasa, sem er líklega bætandi í eðli sínu, sem hægir á lækkun lengdar telómeru í virkum skiljum frumna
undir áhrifum bólgueyðandi frumna. Reyndar, í samanburðarhópnum, fundum við jákvætt samband milli telomerasa virkni og merkja langvarandi bólgu.
Það er mikilvægt að leggja áherslu á að samkvæmt gögnum okkar var stig oxunarálags, langvarandi bólgu og virkni telómerasa hjá sjúklingum með T2DM og „langa“ telómera ekki marktækt frábrugðið samsvarandi vísitölum hjá heilbrigðum einstaklingum. Gera má ráð fyrir að með stuttum tíma T2DM verndar erfðafræðilega ákveðin löng telómeralengd sjúklinga fyrir skaðlegum áhrifum oxunarálags og langvarandi bólgu, sem veitir betri og hraðari endurheimt á skemmdum vefjum, þar með talið æðum. Aftur á móti, hjá sjúklingum með T2DM og „stutta“ telómera, jafnvel með stuttum tíma sjúkdómsins, var alvarleiki langvarandi bólgu og hve minnkandi virkni telómerasa voru marktækari. Hafa ber í huga að sjúklingar með sykursýki af tegund 2 og samanburður voru sambærilegir miðað við aldur.
Vaxandi vísbendingar eru um að stytting telómerna sé lykilþáttur í því að draga úr stofnfrumugildum og hrörnun vefja í tengslum við aldur. Tenging T2DM við ferla öldrunar frumna og alvarleika langvarandi bólgu og oxunarálags getur útskýrt hærra tíðni CVD í þessum sjúkdómi. Frekari rannsóknir munu gera kleift að taka mið af lengd telómerna meðal sjúklinga með sykursýki af tegund 2, hópi fólks sem þarf árásarmeiri stjórn á umbrotum kolvetna, sem mun veita persónulegri nálgun við meðhöndlun sjúkdómsins.
1. Hjá sjúklingum með sykursýki af tegund 2 eru lengd telómera að meðaltali og virkni telómerasa er minni en hjá heilbrigðu fólki. Gildi virkni líkamsmerasa við að breyta lengd telómeranna voru ekki ljós.
2. Magn MDA hjá sjúklingum með sykursýki af tegund 2 og heilbrigðum einstaklingum er næstum það sama. Langvinn bólga er meira áberandi hjá sjúklingum með sykursýki af tegund 2 en hjá heilbrigðum einstaklingum á svipuðum aldri. Langvinn bólga gegnir aðalhlutverki í að stytta telómera og auka virkni telómerasa.
3. Hjá sjúklingum með T2DM og „langa“ telómera er alvarleiki oxunarálags og langvarandi bólgu ekki frábrugðinn samsvarandi breytum hjá heilbrigðum einstaklingum.
4. Hjá sjúklingum með T2DM eru „stuttir“ telómerar tengdir lélegri stjórn á sykursýki og alvarlegri langvinnri bólgu.
5. „Langir“ telómerar vernda sjúklinga með sykursýki gegn skaðlegum áhrifum oxunarálags og langvarandi bólgu.
Það er enginn hagsmunaárekstur.
Rannsóknin var framkvæmd sem hluti af ríkisverkefni "Rannsókn á sameindaaðferðum við æðamyndun í því skyni að þróa aðferðir til að greina snemma sjúkdómsgreining á forklínískri æðakölkun sem helsti sjúkdómsvaldandi aðferð til að þróa hjarta- og æðasjúkdóma og fylgikvilla þeirra."
Rannsóknarhugmynd og hönnun - E.N. Dudinskaya, O.N. Tkacheva, I.D. Strazhesko, E.V. Akasheva.
Söfnun og úrvinnsla efnis - N.V. Brailova, E.V. Plohova, V.S. Pihtina.
Tölfræðileg gagnavinnsla - V.A. Gagnleg.
Að skrifa texta - N.V. Brailova.
Klippingu - E.N. Dudinskaya, O.N. Tkacheva, M.V. Shestakova, S.A. Bardagamenn.
Teymi höfunda þakkar A.S. Kruglikov, I.N. Ozerov, N.V. Gomyranova (fjárlagastofnun sambandsríkisins „Rannsóknamiðstöð ríkisins í fyrirbyggjandi lækningum“ í heilbrigðisráðuneyti Rússlands) og D.A. Skvortsov (Institute of Physical and Chemical Líffræði nefnd eftir AN Belozersky GBOU VPO MSU nefnd eftir MV Lomonosov) fyrir hjálp við framkvæmd rannsóknarinnar.
1. Rajendran P, Rengarajan T, Thangavel J, o.fl. Æðaþelið í æðum og sjúkdómar í mönnum. Int J BiolSci. 2013.9 (10): 1057-1069. doi: 10.7150 / ijbs.7502.
2. Rodier F, Campisi J. Fjögur andlit frumuævinnar. J Cell Biol. 2011,192 (4): 547-556. doi: 10.1083 / jcb.201009094.
3. Inoguchi T, Li P, Umeda F, o.fl. Hátt glúkósastig og frjáls fitusýra örva framleiðslu viðbragðs súrefnis tegunda með prótein 6 kínasa C háð virkjun NAD (P) H oxíðasa í ræktuðum æðum frumum. Sykursýki. 2000.49 (11): 1939-1945.
Benetos A, Gardner JP, Zureik M, o.fl. Stuttir telómerar eru í tengslum við aukna barkæðabólgu í háþrýstingi. Háþrýstingur 2004.43 (2): 182-185. doi: 10.1161 / 01.HYP.0000113081.42868.f4.
Shah AS, Dolan LM, Kimball TR, o.fl. Áhrif á lengd sykursýki, stjórnun á blóðsykri og hefðbundnum áhættuþáttum hjarta- og æðasjúkdóma á æxlisbreytingum á æðum í unglingum
og ungir fullorðnir með sykursýki af tegund 2. J Clin Endocr Metab. 2009.94 (10): 3740-3745. doi: 10.1210 / jc.2008-2039.
7. Zvereva M.E., Scherbakova D.M., Dontsova O.A. Telomerase: uppbygging, aðgerðir og leiðir til að stjórna virkni. // Árangur í líffræðilegri efnafræði. - 2010 .-- T. 50 .-- S. 155-202. Zvereva ME, Shcherbakova DM, Dontsova OA. Telomeraza: struktura, funktsii i puti regulyatsii aktivnosti. Uspekhi biologicheskoi khimii. 2010.50: 155-202. (Í russ.).
8. Morgan G. Telomerase reglugerð og náin tengsl við öldrun. Rannsóknir og skýrslur í lífefnafræði. 2013.3: 71-78.
9. Effros RB. Telomere / telomerase gangverki innan ónæmiskerfisins hjá mönnum: Áhrif langvarandi sýkingar og streitu. Ger Gerðól. 2011.46 (2-3): 135-140.
10. Ludlow AT, Ludlow LW, Roth SM. Aðlagast Telómerar að lífeðlisfræðilegum streitu? Að kanna áhrif æfinga á telomere lengd og telómere-skyld prótein. BioMed Research International. 2013,2013: 1-15.
11. Ghosh A, Saginc G, Leow SC, o.fl. Telómerasa stjórnar NF-xB háðri umritun. Nat Cell Biol. 2012.14 (12): 1270-1281.
12. Qi Nan W, Ling Z, Bing C. Áhrif telómer-telómerasa kerfisins á sykursýki og fylgikvilla í æðum þess. Sérfræðileg skoðunarmarkmið. 2015.19 (6): 849-864. doi: 10.1517 / 14728222.2015.1016500.
13. Cawthon RM. Telomere mæling með magn PCR. Nucleic Acids Res. 2002.30 (10): 47e-47.
14. Kim N, Piatyszek M, Prowse K, o.fl. Sértæk tenging telomerasavirkni manna við ódauðleg frumur og krabbamein Vísindi. 1994,266 (5193): 2011-2015.
15. Huang Q, Zhao J, Miao K, o.fl. Samband milli Telomere Lengdar og sykursýki af tegund 2: A Meta-Greining. Plos eitt. 2013.8 (11): e79993.
16. Sampson MJ, Winterbone MS, Hughes JC, o.fl. Monocyte Telomere stytting og oxun DNA skemmdum í sykursýki af tegund 2. Sykursýki umönnun. 2006.29 (2): 283-289.
17. Kuhlow D, Florian S, von Figura G, o.fl. Telómerasa skortur hefur áhrif á umbrot glúkósa og insúlín seytingu. Öldrun (Albany NY). 2010.2 (10): 650-658.
18. Pal M, Febbraio MA, Whitham M. Frá cýtókíni til mýokíni: hlutverk interleukin-6 í vaxandi umbroti. Immunol Cell Biol. 2014.92 (4): 331-339.
19. Lichterfeld M, O'Donovan A, Pantell MS, o.fl. Uppsöfnuð bólguálag er tengd stuttri hvítfrumnafjölgunartómere í rannsókninni á heilsu, öldrun og líkamsbyggingu. Plos eitt. 2011.6 (5): e19687.
20. Federici M, Rentoukas E, Tsarouhas K, o.fl. Samband milli telomerasa virkni í PBMC og merkjum bólgu og truflun á æðaþels hjá sjúklingum með efnaskiptaheilkenni. Plos eitt. 2012.7 (4): e35739.