Tritace plús
Lyfhrif Ramiprilat, virkt umbrotsefni ramipril, hamlar ensíminu dipeptidyl carboxypeptidase I (samheiti: angiotensin umbreytandi ensím, kininase II). Í plasma og vefjum hvetur þetta ensím umbreytingu angíótensíns I í virkt æðavíkkandi efni (æðavíkkandi) angíótensín II, svo og sundurliðun virka æðavíkkandi bradykinínsins. Að draga úr myndun angíótensíns II og hindra sundurliðun bradykiníns leiðir til stækkunar á æðum.
Þar sem angíótensín II örvar einnig losun aldósteróns minnkar seyting aldósteróns vegna ramiprilats. Aukning á virkni bradýkíníns ákvarðar augljóslega hjartavarnar- og æðaþræðandi áhrif sem komu fram í tilraunum dýra. Í dag er ekki staðfest hvernig þetta hefur áhrif á þróun ákveðinna aukaverkana (til dæmis ertandi hósta).
ACE hemlar eru virkir jafnvel fyrir sjúklinga með háþrýsting, þar sem styrkur reníns í blóðvökva er lítill. Meðalviðbrögð við ACE-hemli einlyfjameðferð hjá sjúklingum með Negroid kynþátt (venjulega hjá íbúum með háþrýsting og lágan styrk reníns) var lægri miðað við fulltrúa annarra kynþátta.
Taka ramipríls veldur verulegri lækkun á viðnámi útlægra slagæða. Almennt breytist plasmaflæði um nýru og gauklasíunarhraði ekki marktækt.
Innleiðing ramipríls hjá sjúklingum með háþrýsting leiðir til lækkunar á blóðþrýstingi þegar hann liggur og stendur án þess að bæta upp hjartsláttartíðni.
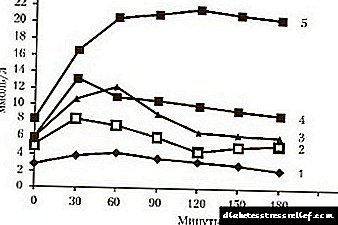
Hjá flestum sjúklingum birtast blóðþrýstingslækkandi áhrif eftir inntöku staks skammts eftir 1-2 klst. Hámarksáhrif staks skammts næst venjulega eftir 3 til 6 klukkustundir og varir venjulega 24 klukkustundir.
Hámarks blóðþrýstingslækkandi áhrif við langvarandi meðferð með ramiprili sést eftir 3-4 vikur. Í ljós kom að við langvarandi meðferð varir það í 2 ár.
Sem svar við skyndilega stöðvun ramipríls er engin hröð og áberandi hækkun á blóðþrýstingi.
Rannsóknin á AIRE sýndi að hjá sjúklingum með klíníska einkenni hjartabilunar, sem meðferð hófst 3 til 10 dögum eftir brátt hjartadrep, minnkaði ramipril hættuna á dánartíðni um 27% samanborið við lyfleysu. Subanalysis leiddi einnig í ljós minnkun á annarri áhættu, þar með talið hættu á skyndidauða (um 30%) og hættuna á framvindu sjúkdómsins við þróun alvarlegrar / viðvarandi hjartabilunar (um 23%). Að auki minnkuðu líkurnar á síðari sjúkrahúsvist vegna hjartabilunar um 26%.
Hjá sjúklingum með nýrnasjúkdóm sem ekki er með sykursýki eða sykursýki, dregur ramipril úr framvindu nýrnabilunar og byrjun nýrnabilunar á lokastigi og þar af leiðandi þörf fyrir skilun eða nýrnaígræðslu. Hjá sjúklingum með nýrnakvilla sem ekki eru með sykursýki eða sykursýki, dregur ramipril úr útskilnaði albúmíns.
Rannsóknin með samanburði við lyfleysu (HOPE rannsókn), sem stóð í 5 ár, náði til sjúklinga 55 ára og eldri sem höfðu aukna hættu á hjarta- og æðasjúkdómum vegna æðasjúkdóma. (svo sem núverandi kransæðasjúkdómur, saga um heilablóðfall eða æðasjúkdóm í æðum) eða sykursýki, með að minnsta kosti einum áhættuþætti til viðbótar (öralbuminuria, háþrýstingur, hækkað almennt stig Kólesteról, lítið HDL kólesteról, reykingar). 4645 sjúklingar, auk venjulegrar meðferðar, notuðu ramipril í fyrirbyggjandi tilgangi. Þessi rannsókn sýndi að ramipril, með mikla tölfræðilega þýðingu, dró úr tíðni hjartadreps, heilablóðfalls eða dauða hjarta- og æðasjúkdóma. Að auki dregur ramipril úr dánartíðni í heild sinni og tilkoma þörf fyrir æðaæxlun og seinkar einnig byrjun og framvindu hjartabilunar. Ramipril dregur úr hættu á nýrnakvilla hjá almenningi og sjúklingum með sykursýki. Ramipril dregur einnig verulega úr tíðni öralbúmínmigu. Slík áhrif komu fram hjá sjúklingum með bæði háþrýsting og eðlilækkun.
Lyfjahvörf Forvirk umbrot forlyfsins, ramipril, eiga sér stað í lifrinni og af því myndast eitt virkt umbrotsefni ramiprilat (með vatnsrofi, sem kemur aðallega fram í lifur). Til viðbótar við slíka virkjun með myndun ramiprilats, gengst ramipril í glúkúrónering og breytist í ramipril diketopiperazine (eter). Ramiprilat er einnig glúkúróníðt og breytt í ramiprilat diketopiperazine (sýru).
Sem afleiðing af þessari virkjun / umbroti forlyfsins er um það bil 20% af ramipríli til inntöku aðgengilegt.
Aðgengi ramiprilats eftir inntöku 2,5 og 5 mg ramipril er um það bil 45% samanborið við framboð hans eftir gjöf sömu skammta í bláæð.
Eftir inntöku 10 mg af ramipríli merktu með geislavirku merkimiði skilst út um það bil 40% af öllum merkimiðanum í hægðum og um það bil 60% í þvagi. Eftir inntöku 5 mg af ramipríli hjá sjúklingum með frárennsli á gallrásum, skiljast út um það bil sama magn af ramipríli og umbrotsefnum þess á fyrstu sólarhringnum með þvagi og galli.
Um það bil 80 til 90% umbrotsefna í þvagi og galli eru umbrotsefni ramiprilat eða ramiprilat. Ramipril glúkúróníð og ramipril diketopiperazin eru um það bil 10 til 20% af heildinni og ómótað ramipril um það bil 2%.
Í dýrarannsóknum hefur reynst að ramipril berist í brjóstamjólk.
Ramipril frásogast hratt eftir inntöku. Eins og staðfest var með því að mæla magn geislavirks merkis í þvagi, sem sýnir aðeins einn af brotthvarfsleiðum, er frásog ramiprils ekki minna en 56%. Að taka ramipril með mat leiddi ekki í ljós marktæk áhrif á frásog.
Hámarksþéttni ramiprils í plasma næst 1 klukkustund eftir inntöku. Helmingunartími ramiprils er um það bil 1 klukkustund. Hámarksstyrkur ramiprilats í plasma sést á milli 2 og 4 klst. Eftir inntöku ramipril.
Lækkun á þéttni ramiprilats í plasma á sér stað í nokkrum stigum. Fyrsta tímabil upphafsstigs dreifingar og brotthvarfs er um það bil 3 klukkustundir. Eftir það er umskiptaskeið (með um það bil 15 klukkustundir) og síðan lokafasinn, þar sem plasmaþéttni ramiprilats er mjög lág, með u.þ.b. 4-5 daga tímabil.
Tilvist lokastigsins vegna hægrar aðgreiningar ramiprilats úr nánu en mettuðu sambandi við ACE.
Þrátt fyrir langan lokastig brotthvarfs, eftir stakan skammt af ramiprili í 2,5 mg skammti eða hærri, næst stöðugt ástand (þegar plasmaþéttni ramiprilats er stöðug) eftir u.þ.b. 4 daga. Eftir endurtekna gjöf er virkur helmingunartími 13-17 klukkustundir, allt eftir skammti.
Rannsóknir in vitro hafa sýnt að hömlunastöðugleiki ramiprilats er 7 mmól / l og aðgreiningartími ramiprilats við ACE er 10,7 klukkustundir, sem bendir til mikillar virkni.
Binding ramipril og ramiprilat við prótein í sermi er um það bil 73 og 56%.
Hjá heilbrigðum einstaklingum á aldrinum 65–76 ára eru hreyfiorka ramipril og ramiprilat svipuð og hjá heilbrigðum einstaklingum á unga aldri.
Við skerta nýrnastarfsemi minnkar útskilnaður ramiprilats í nýrum, nýrnaúthreinsun ramiprilats minnkar í hlutfalli við kreatínín úthreinsun. Þetta veldur hækkun á plasmaþéttni ramiprilats sem lækkar mun hægar en hjá einstaklingum með eðlilega nýrnastarfsemi.
Með því að taka stóra skammta (10 mg) með skerta lifrarstarfsemi, breytist ramipril í ramiprilat síðar, plasmaþéttni ramiprils eykst og útskilnaður ramiprilats hægir.
Eins og hjá heilbrigðum einstaklingum og sjúklingum með háþrýsting, eftir inntöku 5 mg af ramiprili einu sinni á dag í 2 vikur hjá sjúklingum með hjartabilun, var engin marktæk uppsöfnun ramipril og ramiprilat.
Forklínískar upplýsingar. Niðurstöður forklínískra rannsókna benda til þess að engin hætta hafi verið á mönnum samkvæmt stöðluðum rannsóknum á lyfjafræðilegu öryggi, eiturverkunum með endurteknum skömmtum, eiturverkunum á erfðaefni, krabbameinsvaldandi áhrifum.
Ábendingar um notkun lyfsins Tritace
AH (slagæðarháþrýstingur), með það að markmiði að lækka blóðþrýsting sem einlyfjameðferð eða í samsettri meðferð með öðrum blóðþrýstingslækkandi lyfjum, til dæmis þvagræsilyfjum og kalsíumblokka.
Hjartabilun, einnig í tengslum við þvagræsilyf.
Hjartabilun fyrstu dagana eftir brátt hjartadrep.
Glomerular eða upphaf nýrnasjúkdóms eða sykursýki með sykursýki.
Að draga úr hættu á hjartadrepi, heilablóðfalli eða dauðsföllum hjarta- og æðasjúkdóma hjá sjúklingum með aukna hjarta- og æðasjúkdóm vegna kransæðahjartasjúkdóms (með eða án hjartadreps), heilablóðfall, saga um útlægan æðasjúkdóm eða sykursýki með að minnsta kosti einum hjarta- og æðasjúkdómi til viðbótar æðaráhætta (öralbúmínmigu, háþrýstingur, hækkað heildarkólesteról, lítið HDL kólesteról, reykingar).
Notkun lyfsins Tritace
Skömmtun er ákvörðuð í samræmi við áhrif og þol lyfsins fyrir sérstaka sjúklinga.
Tritace töflur verður að gleypa með nægilegu magni af vökva (u.þ.b. 1/2 bolli). Ekki má tyggja eða mylja töflurnar.
Matur hefur ekki marktæk áhrif á frásog ramipríls. Þess vegna er hægt að taka Tritace fyrir, meðan á eða eftir máltíð stendur.
Meðferð við háþrýstingi (slagæðarháþrýstingur).
Ráðlagður upphafsskammtur fyrir fullorðna: 2,5 mg Tritace einu sinni á dag.
Háð svörun sjúklingsins er hægt að auka skammtinn. Mælt er með því að auka skammtinn með því að tvöfalda hann á 2-3 vikna fresti.
Venjulegur viðhaldsskammtur: 2,5 til 5 mg Tritace á dag.
Hámarks leyfilegur dagskammtur fyrir fullorðna: 10 mg Tritace.
Valkostur við að auka skammtinn sem er meira en 5 mg af Tritace á dag, getur verið viðbótarnotkun td þvagræsilyfja eða kalsíumtakaloka.
Meðferð við hjartabilun.
Ráðlagður upphafsskammtur fyrir fullorðna: 1,25 mg Tritace 1 sinni á dag.
Háð svörun sjúklingsins er hægt að auka skammtinn með því að tvöfalda hann á 1-2 vikna fresti. Ef nauðsynlegur skammtur er 2,5 mg af Tritace eða hærri, má taka hann sem stakan skammt eða skipta í tvo skammta.
Hámarks dagsskammtur: 10 mg Tritace.
Meðferð eftir hjartadrep.
Ráðlagður upphafsskammtur: 5 mg Tritace á dag, skipt í 2 skammta af 2,5 mg, einn skammtur er tekinn á morgnana og hinn á kvöldin. Ef sjúklingur þolir ekki slíkan upphafsskammt er mælt með 1,25 mg skammti 2 sinnum á dag í 2 daga.
Síðan, eftir svörun sjúklings, getur skammturinn aukist. Mælt er með því að auka skammtinn með því að tvöfalda hann á 1 til 3 daga fresti.
Í framtíðinni er hægt að taka heildar dagsskammtinn, sem var fyrst skipt í tvennt, í einum skammti.
Hámarks dagsskammtur: 10 mg Tritace.
Reynsla af því að meðhöndla sjúklinga með alvarlega (stig IV, NYHA - New York Heart Association) hjartabilun strax eftir hjartadrep er ekki nóg. Þegar um er að ræða notkun lyfsins Tritace er mælt með því að hefja meðferð með lægsta virka sólarhringsskammtinum (1,25 mg af Tritace einu sinni á dag) og allar aukningar sem fylgja á eftir ætti að fara fram með mikilli varúð.
Meðferð á nýrnakvilla vegna sykursýki eða sykursýki.
Ráðlagður upphafsskammtur fyrir fullorðna: 1,25 mg Tritace 1 sinni á dag.
Það fer eftir þoli sjúklings gagnvart lyfinu, má auka skammtinn í viðhaldsskammt, sem er 5 mg af Tritace 1 sinni á dag.
Skammtar yfir 5 mg af Tritace einu sinni á dag hafa ekki verið rannsakaðir á fullnægjandi hátt í klínískum samanburðarrannsóknum.
Til þess að draga úr hættu á hjartadrepi, heilablóðfalli eða dauða hjarta- og æðasjúkdóma.
Ráðlagður upphafsskammtur fyrir fullorðna: 2,5 mg Tritace 1 sinni á dag.
Það fer eftir þoli sjúklingsins gagnvart lyfinu, hægt er að auka skammtinn smám saman. Mælt er með því að tvöfalda skammtinn eftir 1 viku meðferð og eftir 3 vikur - auka hann í venjulegan viðhaldsskammt, 10 mg Tritace, einu sinni á dag.
Í klínískum samanburðarrannsóknum hefur notkun meira en 10 mg skammts af Tritace einu sinni á dag ekki verið rannsökuð nægjanlega.
Notkun sjúklinga með alvarlega nýrnabilun með kreatínín úthreinsun ≤36 ml / mín. Hefur ekki verið rannsökuð nægjanlega.
Sérstakir sjúklingahópar.
Sjúklingar með skerta nýrnastarfsemi.
Ef kreatínín úthreinsun er 50–20 ml / mín. Á 1,73 m 2 af líkamsyfirborði er venjulega byrjaður daglegur skammtur fullorðins, 1,25 mg af Tritace. Hámarks dagsskammtur í þessu tilfelli er 5 mg af Tritace.
Sjúklingar með ójafnaðan saltajafnvægi í líkamanum, sjúklingar með alvarlegan háþrýsting (slagæðarháþrýsting), svo og sjúklingar sem lágþrýstingsviðbrögð geta haft sérstaka áhættu fyrir (til dæmis með klínískt marktækan þrengingu í kransæða- eða heilaæðum) ætti að nota minni upphafsskammt 1 , 25 mg Tritace á dag.
Sjúklingar sem áður höfðu fengið þvagræsilyf.
Mælt er með því að hætta að taka þvagræsilyf á 2 til 3 dögum eða, háð því hversu lengi verkun þvagræsilyfja er virk, jafnvel fyrr, áður en meðferð með Tritace er hafin, eða að minnsta kosti minnka skammtinn af þvagræsilyfinu. Upphaflegur dagskammtur fyrir fullorðna sjúklinga sem áður hafa notað þvagræsilyf er venjulega 1,25 mg af Tritace.
Sjúklingar með skerta lifrarstarfsemi.
Viðbrögð við meðferð geta annað hvort verið aukin eða minnkuð. Því ætti að hefja meðferð þessara sjúklinga undir ströngu eftirliti læknis. Hámarks dagsskammtur fyrir fullorðna er 2,5 mg af Tritace.
Aldraðir.
Upphafsskammtur ætti að vera lágur - 1,25 mg Tritace á dag.
Frábendingar við notkun lyfsins Tritace
- ofnæmi fyrir ramipríli, öðrum ACE hemli eða einhverju hjálparefnanna sem mynda lyfið,
- saga um ofsabjúg,
- nýrnaslagæðarþrengsli (tvíhliða eða slagæðaþrengsli í stökum nýrum),
- blóðþrýstingslækkandi eða stöðugleikaaðstæður,
- aðal ofnæmisviðbrögð,
- meðgöngutímabil
- brjóstagjöf
- barnaaldur.
Forðist að nota Tritace eða aðra ACE hemla í samsettri meðferð með utanaðkomandi meðferðaraðferðum, sem geta valdið snertingu við blóð á neikvætt hlaðna fleti, þar sem hætta er á alvarlegum bráðaofnæmisviðbrögðum, sem stundum geta leitt til alvarlegs bráðaofnæmislostar.
Þannig er það, þegar Tritace er tekið, ómögulegt að framkvæma skilunar- eða blóðsíunaraðferð með polyacrylonitrile, natríum-2-metýlsúlfónathimnu með mikilli síunarvirkni (til dæmis „AN 69“) og LDL afloðunaraðferð með dextransúlfati.
Aukaverkanir lyfsins Tritace
Þar sem Tritace er blóðþrýstingslækkandi lyf, eru margar aukaverkanir afleiddar af lágþrýstingsáhrifum, sem leiðir til afturkræfra adrenvirkrar örvunar eða lágþrýstings í líffæri. Fjölmörg önnur áhrif (til dæmis áhrif á jafnvægi blóðsalta, ákveðin bráðaofnæmi eða bólguviðbrögð frá slímhimnum) eru af völdum ACE hömlunar eða annarra lyfjafræðilegra áhrifa af þessum lyfjaflokki.
Hjarta og taugakerfi.
Í sjaldgæfum tilvikum geta væg einkenni og viðbrögð komið fram, svo sem höfuðverkur, ójafnvægi, hraðtaktur, máttleysi, syfja, sundl eða lækkun á viðbragðshraða.
Væg viðbrögð og einkenni, svo sem útlægur bjúgur, roði, sundl, eyrnasuð, þreyta, pirringur í taugakerfi, þunglyndi, skjálfti, kvíði, óskýr sjón, svefntruflanir, rugl, kvíði, standandi ristruflanir, tilfinning hjartsláttarónot, of mikil svitamyndun, heyrnarskerðing, syfja, stöðubundin stjórnun, svo og alvarleg viðbrögð eins og hjartaöng, hjartsláttartruflanir og meðvitundarleysi eru sjaldgæf.
Örsjaldan kemur fram alvarlegur lágþrýstingur, hjarta- eða heilablóðþurrð, hjartadrep, skammtímabundinn blóðþurrð, heilablóðþurrð, versnun á truflunum í blóðrás vegna æðasjúkdóms, versnun klínískra einkenna Raynauds fyrirbæra eða náladofa kom fram í einstökum tilvikum.
Nýrna og saltajafnvægi.
Stundum er aukning á magni þvagefnis og kreatíníns í sermi (líkurnar aukast með aukinni notkun þvagræsilyfja) og versnun nýrnastarfsemi, í einstökum tilvikum getur framsókn þróast - þróun bráðrar nýrnabilunar.
Stundum getur styrkur kalíums í sermi aukist. Í einstökum tilvikum getur sermisþéttni natríums lækkað auk þess sem núverandi próteinmigu getur aukist (þrátt fyrir þá staðreynd að ACE hemlar leiða venjulega til lækkunar á próteinmigu) eða aukinnar þvags (vegna bættrar hjartastarfsemi).
Öndunarfæri, bráðaofnæmi / bráðaofnæmi og viðbrögð í húð.
Oft er þurr (óafleiðandi) ertandi hósti. Hósti versnar oft á nóttunni og meðan á hvíld stendur (til dæmis þegar þú leggur þig) og kemur oftar fram hjá konum og einstaklingum sem reykja ekki.
Sjaldan þróast nefstífla, skútabólga, berkjubólga, berkjukrampur og mæði.
Í sjaldgæfum tilvikum er hægt að sjá lyfjafræðilega miðlað ofsabjúg í bjúg (ofsabjúgur af völdum ACE hemla kemur oftar fram hjá sjúklingum í Negroid kappakstrinum samanborið við sjúklinga í öðrum kynþáttum). Alvarleg viðbrögð af þessu tagi og önnur lyfjafræðileg miðluð bráðaofnæmi eða bráðaofnæmisviðbrögð við ramiprili eða öðrum íhlutum eru mjög sjaldgæf.
Viðbrögð frá húð eða slímhúð, svo sem útbrot, kláði eða ofsakláði eru sjaldgæfar. Í mjög sjaldgæfum tilvikum geta komið fram útbrot á augnbotnsfrumum, pemphigus, versnun psoriasis, psoriasiform, pemphigoid eða fléttum exanthema og enanthema, multiceptic roði, Stevens-Johnson heilkenni, eitrað drep í húðþekju, hárlos, ónæmishólun eða photocholism.
Líkurnar á tilvikum og alvarleika bráðaofnæmis og bráðaofnæmisviðbragða við skordýraeitri við hömlun á ACE aukast. Talið er að slík áhrif geti sést með tilliti til annarra ofnæmisvaka.
Meltingarvegur, lifur.
Sjaldan getur komið fram ógleði, aukning á sermisensíum í lifur og / eða bilirubini, svo og gallteppu gulu. Stundum, munnþurrkur, hindrar, óþægindi í kviðarholi, verkir í meltingarfærum, uppnámi í meltingarvegi, hægðatregða, niðurgangur, uppköst og aukin ensím í brisi. Í einstökum tilvikum getur brisbólga eða lifrarskemmdir (þ.mt bráð lifrarbilun) myndast.
Blóðmyndandi viðbrögð.
Stundum getur verið lítil - í sumum tilvikum veruleg - fækkun rauðra blóðkorna og blóðrauða, fjölda hvítra blóðkorna eða blóðflagna. Í einstaka tilfellum sést kyrningahrap, blóðfrumnafæð og beinmergsbæling.
Blóðfræðileg viðbrögð við verkun ACE hemla koma oftar fram hjá sjúklingum með skerta nýrnastarfsemi, sérstaklega við samhliða kollagenósa (til dæmis altæk rauða úlfa eða scleroderma), eða hjá sjúklingum sem nota önnur lyf sem geta valdið breytingum á samsetningu blóðsins.
Í einstökum tilvikum getur blóðlýsublóðleysi myndast.
Aðrar aukaverkanir.
Sjaldan getur tárubólga komið fram, sem og stundum vöðvakrampar, minnkuð kynhvöt, lystarleysi og skert lykt og bragð (til dæmis málmbragð í munni) eða að hluta til, heill, bragðleysi.
Í einangruðum tilvikum sáust æðabólga, vöðvaverkir, liðverkir, hiti og rauðkyrningafæð, auk aukningar á títum andklæddra mótefna.
Sérstakar leiðbeiningar um notkun lyfsins Tritace
Tritace ætti að nota undir stöðugu eftirliti læknis.
Hjá sjúklingum sem fengu meðferð með ACE hemlum komu fram tilvik ofsabjúgs í andliti, útlimum, vörum, tungu, glottis eða koki. Neyðarmeðferð við lífshættulegri ofsabjúg felur í sér tafarlaust gjöf epinephrine (sc eða hægt iv) samhliða hjartalínuriti og blóðþrýstingsstjórnun. Mælt er með sjúkrahúsvist og fylgst með sjúklingnum í að minnsta kosti 12 til 24 klukkustundir þar til einkennin hverfa alveg.
Hjá sjúklingum sem fengu meðferð með ACE hemlum komu fram tilvik ofsabjúgs í þörmum. Þessir sjúklingar kvörtuðu undan kviðverkjum (með eða án ógleði eða uppkasta) og í sumum tilvikum kom ofsabjúgur í andliti einnig fram. Einkenni ofsabjúgs í þörmum hurfu eftir að ACE hemill var stöðvaður.
Ekki er nægjanleg meðferðarreynsla af Tritace fyrir börn, sjúklinga með verulega skerta nýrnastarfsemi (kreatínín úthreinsun undir 20 ml / mín. Á 1,73 m2 líkamsyfirborðs) og sjúklingum sem eru í skilun.
Sjúklingar með aukna virkni renín-angíótensín kerfisins. Við meðferð sjúklinga með aukna virkni renín-angíótensín kerfisins verður að gæta sérstakrar varúðar. Hjá slíkum sjúklingum er hætta á skyndilegri og verulegri lækkun á blóðþrýstingi og skertri nýrnastarfsemi vegna ACE hömlunar, sérstaklega þegar ACE hemill eða samhliða þvagræsilyfi er ávísað í fyrsta eða fyrsta skipti í stærri skammti. Í upphafi lyfjameðferðar eða með aukningu á skammti, skal fara vandlega í blóðþrýsting þar til hætta er á mikilli lækkun á blóðþrýstingi.
Búast má við aukinni virkni renín-angíótensín kerfisins, einkum:
- hjá sjúklingum með alvarlegan og sérstaklega illkynja háþrýsting. Í upphafi meðferðar þarf sérstakt lækniseftirlit,
- hjá sjúklingum með alvarlega hjartabilun eða þegar um er að ræða meðferð með öðrum lyfjum sem lækka blóðþrýsting. Ef um er að ræða alvarlega hjartabilun á fyrsta stigi meðferðar er strangt eftirlit læknis nauðsynlegt,
- hjá sjúklingum með blóðskilun með verulegan vanda við innstreymi eða útstreymi blóðs frá vinstri slegli (til dæmis ósæðarþrengsli eða þrengsli í míturloku eða hjartavöðvakvilla). Í upphafi meðferðar þarftu strangt lækniseftirlit,
- hjá sjúklingum með blóðskilun marktækan nýrnaslagæðaþrengsli. Í upphafi meðferðar þarf strangt lækniseftirlit.
Það getur verið nauðsynlegt að stöðva upphafsmeðferð með þvagræsilyfjum:
- hjá sjúklingum sem áður tóku þvagræsilyf. Ef ekki er hægt að hætta eða minnka skammt þvagræsilyfja er strangt lækniseftirlit nauðsynlegt í upphafi meðferðar,
- hjá sjúklingum með ógn eða ójafnvægi í saltajafnvæginu (vegna ófullnægjandi neyslu á vökva eða salti, eða vegna tjóns þeirra - niðurgangur, þurrku eða mikil svitamyndun, í tilvikum þar sem bætur fyrir skort á vökva og salti eru ófullnægjandi).
Mælt er með að leiðrétta ástand ofþornunar, blóðþurrð í blóði eða salta skort fyrir meðferð (þó, fyrir sjúklinga með hjartabilun, skal meta slíkar úrbætur vandlega með tilliti til hugsanlegrar hættu á of mikið magni). Við klínískt marktækar aðstæður er hægt að hefja meðferð með Tritace eða halda henni áfram meðan gripið er til viðeigandi ráðstafana til að koma í veg fyrir of háan blóðþrýsting og lækkun nýrnastarfsemi.
Sjúklingar með skerta lifrarstarfsemi.
Hjá sjúklingum með skerta lifrarstarfsemi getur svörun við Tritace meðferð annað hvort verið aukin eða minnkuð. Að auki, hjá sjúklingum með verulega skorpulifur í lifur með bjúg og / eða uppstopp, getur virkni renín-angíótensínkerfisins aukist verulega, því þarf að gæta sérstakrar varúðar við meðferð þessara sjúklinga.
Sjúklingar sem veruleg lækkun á blóðþrýstingi hafa í för með sér sérstaka áhættu (til dæmis sjúklingar með blóðskilun með marktækan þrengsli í kransæðum eða heilaæðum), strangt lækniseftirlit er nauðsynlegt í upphafi meðferðar,
Aldraðir.
Hjá öldruðum geta viðbrögðin við ACE hemlum verið meira áberandi. Í upphafi meðferðar er mælt með mati á nýrnastarfsemi.
Mælt er með að fylgjast með nýrnastarfsemi, sérstaklega á fyrstu vikum meðferðar með ACE hemli. Sérstaklega vandað eftirlit er nauðsynlegt fyrir sjúklinga með:
- hjartabilun
- æðasjúkdómur, þar með talið sjúklingar með blóðskilun, marktækt einhliða nýrnaslagæðarþrengsli. Í síðari hópnum sjúklinga getur jafnvel lítilsháttar aukning á kreatíníngildum í sermi bent til lækkunar á nýrnastarfsemi,
- skert nýrnastarfsemi,
- ígrædda nýrun.
Eftirlit með saltajafnvægi.
Mælt er með því að reglulega sé fylgst með styrk kalíums í sermi. Oftara eftirlit er haft með kalíumgildum í sermi hjá sjúklingum með skerta nýrnastarfsemi.
Hematologic eftirlit.
Mælt er með að fylgjast með fjölda hvítfrumna til að greina tímanlega mögulega hvítfrumnafæð. Mælt er með tíðari eftirliti í upphafi meðferðar hjá sjúklingum með skerta nýrnastarfsemi, með samhliða kollagenósu (altæk rauða úlfa eða scleroderma) eða sjúklingum sem fá meðferð með öðrum lyfjum sem hafa áhrif á blóðrauða.
Notist á meðgöngu og við brjóstagjöf.
Á meðgöngu er óheimilt að taka Tritace (sjá kafla frábendingar). Þess vegna er nauðsynlegt að útiloka hugsanlega meðgöngu áður en lyfið er tekið á konum á barneignaraldri. Konur á barneignaraldri ættu að nota áreiðanlegar getnaðarvarnir meðan þær taka Tritace. Ef kona vill verða barnshafandi skaltu hætta að nota lyfið og skipta því út fyrir önnur lyf (að undanskildum ACE hemlum). Ef ekki er hægt að stöðva meðferð með ACE-hemlum, ætti að koma í veg fyrir meðgöngu. Ef þungun er staðfest meðan á meðferð með Tritace stendur er nauðsynlegt að skipta eins fljótt og auðið er (undir eftirliti læknis) yfir í annað meðferðarlyf sem er minni hætta á fóstrið (að undanskildum ACE hemlum).
Dýrarannsóknir hafa sýnt að ramipril berst í brjóstamjólk. Þar sem ekki er vitað hvort ramipril berst í brjóstamjólk er frábending frá notkun Tritace meðan á brjóstagjöf stendur.
Börn. Vegna skorts á nægilegri klínískri reynslu ætti ekki að ávísa Tritace börnum.
Hæfni til að hafa áhrif á viðbragðshraða þegar ekið er eða unnið með önnur tæki.Sumar aukaverkanir (til dæmis einkenni lækkunar á blóðþrýstingi, einkum ógleði, sundl) geta skert athygli sjúklingsins og geðhreyfihlutfall.
Lyf milliverkanir Tritace
Samsettar frábendingar.
Aðferðir við utanaðkomandi meðhöndlun, sem leiða til snertingar blóðs með neikvætt hlaðnu yfirborði, svo sem himnuskilun eða hemofítrun með því að nota ákveðnar himnur með háan rennslishraða (til dæmis polyacrylonitrile himnur) og Ldl afferesis með dextrinsúlfati.
Samsetningar sem ekki er mælt með.
Kalíumsölt, kalíumsparandi þvagræsilyf: Búast má við aukningu á styrk kalíums í sermi. Við samtímis meðferð með ramipríli með kalíumsparandi þvagræsilyfjum (til dæmis spironolactone) eða kalíumsöltum, er nákvæmt eftirlit með styrk kalíums í sermi nauðsynlegt.
Notið með varúð.
Blóðþrýstingslækkandi lyf (t.d. þvagræsilyf) og önnur lyf geta lækkað blóðþrýsting (t.d. nítröt, þríhringlaga þunglyndislyf, svæfingarlyf): Búast má við aukningu á blóðþrýstingslækkandi áhrifum ramipríls. Mælt er með því að fylgjast reglulega með styrk natríums í sermi hjá sjúklingum sem fá samtímis meðferð með þvagræsilyfjum.
Vasoconstrictive sympathometics: getur dregið úr áhrifum lækkunar á blóðþrýstingi í Tritace. Mælt er með að fylgjast sérstaklega með blóðþrýstingi. Allopurinol, ónæmisbælandi lyf, sykurstera, prokaínamíð, frumuhemjandi lyf og önnur lyf sem geta valdið breytingum á blóðrauða: geta aukið líkurnar á blóðmyndunarviðbrögðum þegar þau eru notuð samtímis ramipríli.
Litíumsölt. Útskilnaður litíums með ACE hemlum getur verið minni. Slík lækkun getur leitt til aukinnar þéttni litíums í sermi og aukinnar litíumeiturhrifa. Í þessu sambandi er nauðsynlegt að stjórna styrk litíums í blóðserminu.
Sykursýkilyf (t.d. insúlín og súlfonýlúrea afleiður). ACE hemlar geta aukið áhrif insúlíns. Í sumum tilvikum getur þetta leitt til þróunar á blóðsykurslækkun hjá sjúklingum sem nota samtímis sykursýkislyf. Í upphafi meðferðar er mælt með vandlega eftirliti með magni glúkósa í blóði.
Matur breytir ekki frásogi ramiprils verulega.
Ætti að taka tillit til þess.
Bólgueyðandi gigtarlyf (t.d. indómetasín og asetýlsalisýlsýra). Ef til vill að veikja áhrif lækkunar á blóðþrýstingi undir verkun Tritace. Að auki getur samtímis meðferð með ACE hemlum og bólgueyðandi gigtarlyfjum valdið aukinni hættu á skerta nýrnastarfsemi og hækkuðu kalíumgildi í sermi.
Heparín. Aukning á styrk kalíums í sermi er möguleg.
Áfengi: eykur æðavíkkun. Tritace getur aukið áhrif áfengis.
Salt Aukin saltneysla getur dregið úr blóðþrýstingslækkandi áhrifum Tritace.
Aðferðin við sértæka ofnæmisaðgerð. Vegna ACE hömlunar aukast líkur og alvarleiki bráðaofnæmis og bráðaofnæmis viðbrögð við skordýraeitri.Lagt er til að einnig sé hægt að sjá slík áhrif með tilliti til annarra ofnæmisvaka.
Ofskömmtun lyfsins Tritace, einkenni og meðferð
Einkenni vímuefna. Ofskömmtun getur valdið mikilli þenslu á útlægum skipum (með alvarlega lágþrýsting, lost), hægslátt, ójafnvægi í saltajafnvæginu og nýrnabilun.
Vímuefnameðferð. Aðal afeitrun, til dæmis með því að þvo magann, notkun aðsogsefna, natríumþíósúlfat (ef mögulegt er, á fyrstu 30 mínútunum). Ef lágþrýstingur er, auk ráðstöfunar sem miðar að því að endurheimta vökvamagn og saltjafnvægi, er nauðsynlegt að nota örva α1-adrenvirkra viðtaka (til dæmis noradrenalín, dópamín) eða angíótensín II (angíótensínamíð), sem að jafnaði er aðeins fáanlegt í einstökum rannsóknum. rannsóknarstofur.
Engin gögn liggja fyrir um virkni þvingaðrar þvagræsingar, breytinga á svörun í þvagi, blóðsíun eða skilun með tilliti til flýta fyrir brotthvarfi ramipril eða ramiprilat. Hins vegar er verið að íhuga möguleikann á skilun eða blóðsíun.
Skammtaform
Grunn eðlis- og efnafræðilegir eiginleikar:
Tritace PLUS ® 5 mg / 12,5 mg eru ílangar bleikar töflur með skilalínu á báðum hliðum. Efsti frímerki: 41 / AV.
Tritace PLUS ® 10 mg / 12,5 mg aflöng appelsínugul tafla með deililínu á báðum hliðum. Efsti frímerki 42 / AV.
Milliverkanir við önnur lyf og aðrar tegundir milliverkana
Maturinn. Samtímis fæðuinntaka hefur ekki marktæk áhrif á frásog ramipríls.
Aðferðir við utanaðkomandi meðferð, sem leiðir til snertingar blóðs með neikvætt hlaðnu yfirborði, svo sem himnuskilun eða hemofítrati með því að nota ákveðnar himnur með háan rennslishraða (til dæmis polyacrylonitrile himnur) og aðferði lítilli þéttni fitupróteina með dextransúlfati - í ljósi aukinnar hættu á að þróa alvarlega bráðaofnæmi. viðbrögð (sjá
Ekki má nota samtímis lyfjum sem innihalda aliskiren til notkunar hjá sjúklingum með sykursýki eða hjá sjúklingum með í meðallagi eða alvarlega skerta nýrnastarfsemi (kreatínín úthreinsun.
Samtímis notkun angíótensín II viðtakablokka með lyfjum er frábending til notkunar hjá sjúklingum með nýrnakvilla vegna sykursýki en er ekki ráðlögð til notkunar hjá öllum öðrum sjúklingum.
Samsetningar sem krefjast mikillar varúðar.
Kalíumsölt, heparín, kalíumsparandi þvagræsilyf og önnur virk efni sem auka magn kalíums í blóðvökva (þar með talið angíótensín II mótlyf, trimethoprim, takrolimus, cyclosporine). Blóðkalíumlækkun getur komið fram, svo þú þarft að fylgjast vandlega með kalíumþéttni í blóðvökva.
Blóðþrýstingslækkandi lyf (t.d. þvagræsilyf) og önnur virk efni sem geta lækkað blóðþrýsting (t.d. nítröt, þríhringlaga þunglyndislyf, svæfingarlyf, áfengi, baclofen, alfuzosin, doxazosin, prazosin, tamsulosin, terazosin). Hugsanleg aukning getur verið á hættu á lágþrýstingi í slagæðum (sjá kaflann „Skammtar og lyfjagjöf“ vegna þvagræsilyfja).
Virkni lyfja frá vasopressor og öðrum virkum efnum (t.d. epinephrine), sem geta dregið úr blóðþrýstingslækkandi áhrifum ramipril. Mælt er með því að fylgjast reglulega með blóðþrýstingi.
Allopurinol, ónæmisbælandi lyf, barksterar, prókaínamíð, frumudrepandi lyf og önnur efni sem geta valdið breytingum á blóðmynd. Auknar líkur á blóðmyndunarviðbrögðum (sjá kafla „Lögun forritsins“).
Litíumsölt. Þar sem ACE hemlar geta dregið úr útskilnaði litíums getur það leitt til aukinnar lití eitrunar.
Sykursýkilyf, þ.mt insúlín. Blóðsykursfall getur komið fram. Hýdróklórtíazíð getur dregið úr áhrifum sykursýkislyfja. Þess vegna er það nauðsynlegt í upphafi samtímis notkunar þessara lyfja að fylgjast vel með magni glúkósa í blóði. Nota skal metformín með varúð miðað við hættu á mjólkursýrublóðsýringu vegna hugsanlegrar nýrnabilunar vegna hýdróklórtíazíðs.
Bólgueyðandi gigtarlyf (NSAID) og asetýlsalisýlsýra. Búist er við lækkun á blóðþrýstingslækkandi áhrifum Tritace Plus ®. Að auki getur samtímis notkun ACE hemla og bólgueyðandi gigtarlyfja fylgt aukin hætta á skerta nýrnastarfsemi og hækkun kalíums í blóði.
Segavarnarlyf til inntöku . Við samtímis notkun með hýdróklórtíazíði geta segavarnaráhrifin veikst.
Barksterar, ACTH, amfótericín B, karbenoxólón, notkun á miklu magni af lakkrís, hægðalyf (við langvarandi notkun) og önnur lyf sem notuð eru samtímis eða virk efni sem draga úr magni kalíums í blóðvökva. Aukin hætta á blóðkalíumlækkun.
Digitalis efnablöndur, virk efni sem geta aukið lengd QT-bils, lyf við hjartsláttartruflunum. Þegar blóðsaltajafnvægi er til staðar (til dæmis blóðkalíumlækkun, blóðmagnesíumlækkun), geta hjartsláttartruflanir aukist og hjartsláttaróreglu áhrif geta veikst.
Lyf sem hafa áhrif á áhrif á kalíumgildi í sermi
Mælt er með reglubundnu eftirliti með kalíumgildum í sermi og hjartalínuritsskoðun ef hýdróklórtíazíð er tekið samtímis lyfjum sem hafa áhrif á breytingar á kalíumgildum í sermi (til dæmis digitalis glýkósíð og lyf við hjartsláttartruflunum) og eftirtalin lyf sem valda fjölbrigða hraðslátt af tegund piruette ( sleglahraðsláttur (þar með talið nokkur hjartsláttartruflanir), þar sem blóðkalíumlækkun er þáttur sem stuðlar að þróun hjartavöðva við pirouette:
- Lyf gegn hjartsláttaróreglu í flokki Ia (kínidín, hýdrókínidín, dísópýramíð)
- lyf gegn hjartsláttaróreglu í flokki III (amíódarón, sótalól, dofetilíð, ibútíð)
- sum geðrofslyf (t.d. tíórídasín, klórprómasín, levómepromazín, tríflúoróazín, ciamemazín, sulpíríð, sultópríð, amisulpíríð, tíapríð, pimózíð, halóperidól, droperidól)
- önnur lyf (t.d. bepridil, cisapride, difemanil, erythromycin til gjafar í bláæð, halofantrin, misolastin, pentamidine, terfenadin, vincamine til gjafar í bláæð).
Methyldopa. Tilkynnt hefur verið um nokkur tilvik af blóðlýsublóðleysi við samtímis notkun hýdróklórtíazíðs og metyldopa.
Kólestýramín eða önnur jónaskiptar kvoða sem eru tekin til inntöku. Skert frásog hýdróklórtíazíðs. Taka skal súlfónamíð þvagræsilyf að minnsta kosti 1:00 fyrir eða 4-6 klukkustundum eftir notkun þessara lyfja.
Sígildar vöðvaslakandi lyf. Getur aukið og aukið lengd vöðvaslakandi lyfja.
Kalsíumsölt og lyf sem auka magn kalsíums í blóðinu. Við samtímis notkun með hýdróklórtíazíði má búast við aukningu á kalsíumþéttni í plasma, þess vegna er nauðsynlegt að fylgjast vel með magni kalsíums í blóðvökva.
Karbamazepín. Hætta er á blóðnatríumlækkun vegna aukinna áhrifa hýdróklórtíazíðs.
Skuggaefni sem innihalda joð. Þegar um er að ræða ofþornun sem stafar af notkun þvagræsilyfja, þar með talið hýdróklórtíazíðs, er aukin hætta á bráðum nýrnabilun, sérstaklega þegar gefnir eru verulegir skammtar af skuggaefni sem inniheldur joð.
Penicillin. Útskilnaður hýdróklórtíazíðs á sér stað í fjarlægum túpum nefróns, vegna þess að útskilnaður penicillíns er minni.
Kínín. Hýdróklórtíazíð dregur úr útskilnaði kíníns.
Vildagliptin. Aukning á tíðni ofsabjúgs kom fram hjá sjúklingum sem taka samtímis ACE hemla og vildagliptin.
MTOR hemlar (td Temsirolimus) . Aukning varð á tíðni ofsabjúgs hjá sjúklingum sem taka samtímis ACE hemla og mTOR hemla (markmið rapamycins hjá spendýrum).
Heparín. Hugsanleg aukning á styrk kalíums í sermi.
Þegar stórir skammtar af salisýlati eru notaðir getur hýdróklórtíazíð aukið eiturverkanir þeirra á miðtaugakerfið.
Við samtímis notkun cíklósporíns getur blóðþurrð í blóði aukist og hættan á fylgikvillum eins og þvagsýrugigt aukist.
Áfengi Ramipril getur leitt til aukinnar æðavíkkunar og þannig aukið áhrif áfengis.
Áfengi, barbitúröt, lyf eða þunglyndislyf. Getur aukið réttstöðuþrýstingsfall.
Salt Hugsanleg veiking blóðþrýstingslækkandi áhrifa lyfsins með aukningu á saltinntöku í mataræði.
Betablokkar og díaxósíð. Samtímis notkun tíazíð þvagræsilyfja, þ.mt hýdróklórtíazíðs, ásamt beta-blokkum getur aukið hættuna á blóðsykursfalli.
Amantadine. Tíazíð, þ.mt hýdróklórtíazíð, geta aukið hættu á aukaverkunum af amantadíni.
Pressóramín (t.d. adrenalín). Það er mögulegt að veikja áhrif pressóramína, en ekki að því marki sem útilokar notkun þeirra.
Lyf gegn þvagsýrugigt (próbenesíð, sulfinpyrazone og allopurinol). Nauðsynlegt getur verið að breyta skömmtum á þvagfærasjúkdómum þar sem hýdróklórtíazíð getur aukið þéttni þvagsýru í sermi. Líklegt er að þörf verði á að auka skammtinn af próbenesíði eða sulfinpyrazone. Við samtímis notkun tíazíða er aukning á tíðni ofnæmisviðbragða fyrir allopurinol möguleg.
Andkólínvirk lyf (t.d. atrópín, biperiden). Vegna veikingar á hreyfigetu í meltingarvegi og lækkunar á rýmingarhraða frá maga eykst aðgengi þvagræsilyfja af tíazíðgerð.
Áhrif lyfja á niðurstöður rannsóknarstofu
Vegna áhrifa á umbrot kalsíums geta tíazíð haft áhrif á niðurstöður mats á virkni skjaldkirtils (sjá kafla „Notkunareiginleikar“).
Sérstök ofnæmisaðgerð. Vegna ACE hömlunar aukast líkur og alvarleiki bráðaofnæmis og bráðaofnæmis viðbrögð við skordýraeitri. Talið er að þessi áhrif geti einnig orðið vart við önnur ofnæmi.
Aðgerðir forrita
Sérstakir sjúklingahópar
Meðganga Ekki skal hefja meðferð með ACE hemlum eða angíótensín II viðtakablokkum á meðgöngu. Nema áframhaldandi meðferð með ACE-hemli / angíótensín II viðtakablokki sé algerlega nauðsynleg, ætti að flytja sjúklinga sem hyggjast verða barnshafandi á annað blóðþrýstingslækkandi lyf sem notkun er talin örugg á meðgöngu.
Tvöföld blokkun renín-angíótensíns (RAAS) með lyfjum sem innihalda aliskiren
Ekki er mælt með tvöföldum hömlun renín-angíótensíns með samhliða notkun lyfsins Tritace Plus ® og aliskiren, þar sem aukin hætta er á lágþrýstingi, blóðkalíumlækkun og breytingum á nýrnastarfsemi.
Fyrir sjúklinga með sykursýki eða skerta nýrnastarfsemi (GFR 60 ml / mín.), Má ekki nota samhliða notkun Tritace Plus ® og aliskiren (sjá kafla „frábendingar“).
Sjúklingar sem eru í mikilli hættu á slagæðaþrýstingsfalli
Sjúklingar með aukna virkni renín-angíótensíns. Hjá sjúklingum með aukna virkni renín-angíótensíns er hætta á skyndilegri lækkun á blóðþrýstingi og skert nýrnastarfsemi vegna hömlunar á ACE. Þetta á sérstaklega við í tilvikum þar sem ávísað er ACE-hemli eða samhliða þvagræsilyfi í fyrsta skipti eða skammturinn er aukinn í fyrsta skipti. Búast má við aukningu á virkni læknisskoðunar sem þarfnast renín-angíótensíns, þ.mt stöðugt eftirlit með blóðþrýstingi, til dæmis hjá sjúklingum:
- með alvarlegan háþrýsting í slagæðum,
- með sundraðri hjartabilun,
- með hemodynamically marktækri hindrun á leiðum innstreymis eða útflæði blóðs frá vinstri slegli (til dæmis þrengsli í ósæðar eða míturloku)
- með einhliða nýrnaslagæðarþrengsli í viðurvist annarrar nýrnastarfsemi
- með alvarlega eða dulda skort á vökva eða salta (þar með talið sjúklingum sem fá þvagræsilyf),
- með skorpulifur og / eða uppstopp,
- sem gangast undir umfangsmikla skurðaðgerð eða við svæfingu með lyfjum sem geta valdið lágþrýstingi í slagæðum.
Áður en meðferð er hafin er venjulega mælt með því að leiðrétta ofþornun, blóðþurrð í blóði eða salta skort (þó hjá sjúklingum með hjartabilun, ætti að vega vandlega slíkar úrbætur með tilliti til hættu á of mikið magni).
Hjá sjúklingum með skerta lifrarstarfsemi getur viðbrögð við meðferð með Tritace Plus verið ýmist aukin eða minnkuð. Að auki, hjá sjúklingum með verulegan skorpulifur, sem fylgir bjúg og / eða uppstopp, getur virkni renín-angíótensínkerfisins aukist verulega, því þarf að gæta sérstakrar varúðar við meðferð þessara sjúklinga.
Skurðaðgerð. Ef mögulegt er, skal hætta meðferð með ACE hemlum, svo sem ramipril, 1 degi fyrir aðgerð.
Sjúklingar sem eru í hættu á blóðþurrð í hjarta eða heila við bráða slagæðaþrýsting. Í upphafi meðferðar þarf sjúklingur vandlega lækniseftirlit.
Aðal ofnæmisviðtaka. Samsetning ramipríls + hýdróklórtíazíðs er ekki það lyf sem valið er við meðhöndlun frumdreifitruflunar. Samt sem áður, ef ramipril + hýdróklórtíazíð er notað hjá sjúklingi með frumkomið oförvunarheilkenni, er nauðsynlegt að fylgjast vandlega með kalíumþéttni í blóðvökva.
Aldraðir sjúklingar. Sjá kaflann „Skammtar og lyfjagjöf“.
Sjúklingar með lifrarsjúkdóm. Hjá sjúklingum með lifrarsjúkdóma getur ójafnvægi í salta vegna meðferðar með þvagræsilyfjum hýdróklórtíazíð leitt til þróunar á heilakvilla í lifur.
Ef um lifrarsjúkdóma er að ræða og hjá sjúklingum sem þjást af framsæknum lifrarsjúkdómum, skal nota tíazíð með varúð þar sem þessi lyf geta valdið meltingarvegi í meltingarfærum, svo og lágmarksbreytingum á vatns-saltjafnvægi sem getur valdið þróun dá í lifur. Ekki má nota hypótíazíð handa sjúklingum með verulega skerta lifrarstarfsemi (sjá kafla „Frábendingar“).
Eftirlit með nýrnastarfsemi. Fylgjast verður með nýrnastarfsemi fyrir og meðan á meðferð stendur og aðlaga skal skammtinn í samræmi við það, sérstaklega á fyrstu vikum meðferðar. Sjúklingar með skerta nýrnastarfsemi (sjá kafla „Skammtar og lyfjagjöf“) þurfa sérstaklega vandlega eftirlit.
Sjúklingar með skerta nýrnastarfsemi. Hjá sjúklingum með nýrnasjúkdóm geta tíazíð komið af stað skyndilega útliti í þvagi. Hjá sjúklingum með skerta nýrnastarfsemi geta uppsöfnuð áhrif virkra efna komið fram.Ef framvinda nýrnastarfsemi kemur í ljós, eins og gefið er til kynna með aukningu á magni köfnunarefnis sem eftir er, skal vega vandlega ákvörðunina um að framlengja meðferð. Hafa ber í huga að hætta meðferð með þvagræsilyfjum (sjá kafla „frábendingar“).
Ójafnvægi í salta. Eins og hjá öllum sjúklingum sem fá meðferð með þvagræsilyfjum er nauðsynlegt að mæla magn salta í blóðvökva með viðeigandi millibili. Tíazíð, þar með talið hýdróklórtíazíð, geta valdið broti á jafnvægi vatns-salta (blóðkalíumlækkun, blóðnatríumlækkun og blóðklóríð basískri basa).
Þrátt fyrir að blóðkalíumlækkun geti myndast við þvagræsilyf af tíazíði, getur samtímis notkun ramipríls dregið úr blóðkalíumlækkun af völdum þvagræsilyfja. Hættan á blóðkalíumlækkun er mest hjá sjúklingum með skorpulifur, sjúklingum með aukna þvagræsingu, hjá sjúklingum sem fá ófullnægjandi salta, svo og hjá sjúklingum sem eru samtímis að fá meðferð með barksterum og ACTH (sjá kafla „Milliverkanir við önnur lyf og aðrar gerðir af samspil “). Á fyrstu viku meðferðar skal ákvarða upphaf kalíums í plasma. Ef lægra kalíumgildi finnast er leiðrétting nauðsynleg.
Útvíkkun blóðnatríumlækkunar getur komið fram. Lágt magn natríums getur í upphafi verið einkennalaus, svo regluleg ákvörðun um magn þess er mjög mikilvæg. Hjá öldruðum sjúklingum og sjúklingum með skorpulifur ætti að gera slíkar prófanir mun oftar.
Sýnt hefur verið fram á að tíazíð auka magnesíum útskilnað í þvagi, sem getur leitt til blóðmagnesíumlækkunar.
Blóðkalíumlækkun Hjá sumum sjúklingum sem fengu ACE hemla, svo sem Tritace Plus ®, kom fram blóðkalíumlækkun. Í áhættuhópnum fyrir blóðkalíumhækkun eru sjúklingar með nýrnabilun, aldraðir (eldri en 70 ára), sjúklingar með ómeðhöndlað eða ófullnægjandi stjórn á sykursýki eða þeir sem taka kalíumsölt, kalíumsparandi þvagræsilyf og önnur virk efni sem auka kalíumgildi í plasma blóð, eða sjúklingar með sjúkdóma eins og ofþornun, bráða hjartalækkun eða efnaskiptablóðsýringu. Ef bent er á samtímis notkun ofangreindra lyfja er mælt með því að fylgjast reglulega með magni kalíums í blóðvökva (sjá kafla „Milliverkanir við önnur lyf og aðrar tegundir milliverkana“).
Heilakvilla í lifur. Hjá sjúklingum með lifrarsjúkdóma getur saltajafnvægi sem stafar af meðferð með þvagræsilyfjum, þar með talið hýdróklórtíazíði, leitt til þróunar á heilakvilla í lifur. Ef um er að ræða lifrarheilakvilla, skal hætta meðferð strax.
Blóðkalsíumlækkun. Hýdróklórtíazíð örvar endurupptöku kalsíums í nýrum, sem getur leitt til blóðkalsíumhækkunar. Þetta getur raskað niðurstöðum prófana sem gerðar eru til að kanna virkni skjaldkirtils.
Ofsabjúgur. Hjá sjúklingum sem fengu ACE hemla, svo sem ramipril, sást ofsabjúgur (sjá kafla „Aukaverkanir“). Ef ofsabjúgur verður, skal tafarlaust hætta meðferð með Tritace Plus ® og hefja bráðameðferð. Sjúklingurinn ætti að vera undir eftirliti læknis í að minnsta kosti 12-24 klukkustundir og hann má aðeins útskrifaður eftir að einkennin eru horfin alveg.
Hjá sjúklingum sem fá ACE hemla, svo sem Tritace Plus ®, hafa verið tilvik ofsabjúgs í þörmum (sjá kafla „Aukaverkanir“). Þessir sjúklingar kvörtuðu undan kviðverkjum (með eða án ógleði / uppkasta).
Bráðaofnæmisviðbrögð við ofnæmisaðgerð. Með notkun ACE hemla aukast líkurnar á því að bráðaofnæmi og bráðaofnæmisviðbrögð komi fram við skordýraeitri og öðrum ofnæmisvökum.
Daufkyrningafæð / kyrningahrap. Tilfelli daufkyrningafæðar / kyrningafæðar hafa verið sjaldgæf. Einnig hefur verið greint frá hömlun á starfsemi beinmergs. Til að greina mögulega hvítfrumnafæð er mælt með því að stjórna fjölda hvítra blóðkorna í blóði. Mælt er með tíðara eftirliti í upphafi meðferðar hjá sjúklingum með skerta nýrnastarfsemi, hjá sjúklingum með samhliða kollagenósu (til dæmis altæk rauða úlfa eða scleroderma) og þá sem eru að taka önnur lyf sem geta valdið breytingum á blóðmynd (sjá kafla „ milliverkanir við önnur lyf og aðrar tegundir milliverkana “og„ Aukaverkanir “).
Þjóðernismunur. ACE hemlar eru mun líklegri til að valda ofsabjúg hjá sjúklingum í Negroid kappakstrinum en hjá fulltrúum annarra kynþátta. Eins og aðrir ACE hemlar geta lágþrýstingsáhrif ramiprils verið minni hjá sjúklingum í Negroid kynþáttnum samanborið við fulltrúa annarra kynþátta. Þetta getur stafað af því að hjá svörtum sjúklingum með slagæðarháþrýsting er oftar vart við slagæðarháþrýsting með litla renínvirkni.
Íþróttamenn Hýdróklórtíazíð getur gefið jákvæða niðurstöðu þegar lyfjapróf er framkvæmt.
Efnaskipta- og innkirtlaáhrif. Tíazíðmeðferð getur skert glúkósaþol. Í sumum tilvikum geta sjúklingar með sykursýki þurft að aðlaga skammta insúlíns og sykursýkislyfja til inntöku. Þegar það er meðhöndlað með tíazíðum getur dulda form sykursýki þróast í birtingarmynd.
Tíazíð þvagræsimeðferð getur tengst hækkuðu kólesteróli og þríglýseríðum. Hjá sumum sjúklingum getur notkun tíazíð þvagræsilyfja valdið þroskun þvagsýru eða bráða þvagsýrugigt.
Hóstandi. Við notkun ACE hemla hefur verið greint frá hósta. Að jafnaði er þessi hósti óafleiðandi, langvarandi og hverfur eftir að meðferð lýkur. Við mismunagreiningu á hósta ættir þú að muna hvort möguleiki er á hósti af völdum ACE hemla.
Bráð nærsýni og aukinn bráð gláku. Hýdróklórtíazíð er súlfónamíðblanda. Súlfanilamíð og súlfónamíðafleiður geta valdið einkennum sem geta leitt til tímabundinnar nærsýni og bráðrar gláku í hornhorni. Einkenni fela í sér brátt upphaf minnkaðs sjónskerpis eða verkja í augum og koma venjulega fram á nokkrum klukkustundum til nokkrum vikum eftir að lyfið er byrjað.
Ómeðhöndlað bráð gláku getur leitt til varanlegrar sjónskerðingar. Aðalmeðferðin við þessu ástandi er að hætta að taka lyfið eins fljótt og auðið er. Bráð læknishjálp eða skurðaðgerð getur verið nauðsynleg ef augnþrýstingur er ekki stjórnaður. Áhættuþættir fyrir bráða gláku með hornlokun geta verið sögu um súlfónamíð eða penicillínofnæmi.
Dr. Hjá sjúklingum, óháð tilvist sögu um alla
Slepptu formi
Tritace Plus er fáanlegt í töfluformi.
Töflur eru ílangar bleikar að lit, á hvorri hlið er skilin áhætta. Efst er stimpill 41 / AV. Stakar dökk innifalin eru leyfð.
Pilla er ílöng appelsínugul að lit, á báðum hliðum er áhættuskilin. Efst er stimpill 42 / AY. Stakar dökk innifalin eru leyfð.
Töflurnar eru næstum hvítar, kremlitaðar með deilihættu, ílöng lögun. Á báðum hliðum er fyrirtækjamerki og HNW stimpill.
Pilla bleikur ílangar. Skipt er áhættu á báða bóga. Efsti frímerki 39 / AV. Stakir dökkir blettir eru leyfðir.
Lyfjafræðileg verkun
Sameinað blóðþrýstingslækkandi lyf, sem inniheldur 2 virka íhluti.
Núverandi hluti er ACE ensímhemill. Meginreglan um áhrif byggist á því að koma í veg fyrir umbreytingu á einni mynd angíótensín (I) til annars (II).
Í þessu tilfelli er engin aukning á hjartslætti með jöfnunarbúnaðinum, framleiðsla er ekki minni aldósterón, þrýstingsstig í háræðum lungnakerfisins breytist ekki, eykst ekki kransæðaveitu, síunarhraðinn í glomeruli í nýrnakerfinu breytist ekki og viðnám í æðum lungnakerfisins er áfram í upphafsstiginu.
Klínískar rannsóknir hafa sýnt að langtímameðferð leiðir til lækkunar á alvarleika hjartavöðvakvilla hjá sjúklingum sem þjást háþrýstingur. Í blóðþurrð hjartavöðva Ramipril eykur blóðrásina, dregur úr tíðni endurflæðis hjartavöðva og hættu á þroska hjartsláttartruflanir.
Hjartaverndandi (hjarta + verndun) áhrif næst vegna áhrifa á myndunarferlið prostaglandinsog einnig vegna örvunar myndunar nituroxíðs í æðaþelsfrumum. Virka efnið er hægt að minnka samloðun blóðflagna.
Hýdróklórtíazíð
Núverandi hluti er tíazíð þvagræsilyfog er fær um að breyta endurupptöku kalíums, klórs, natríums, magnesíumjóna. Tafir á virku efni þvagsýra hægir á að útskilja kalsíumjónir í líkamanum, breytir frásogi vatns í neffrónum (fjarlægur hluti).
Blóðþrýstingslækkandi verkun næst með því að auka þunglyndisáhrifin gegn glæru, draga úr alvarleika pressuáhrifa noradrenalín, adrenalín og önnur æðaþrengjandi amín, vegna lækkunar á BCC. Undir venjulegu blóðþrýstingur blóðþrýstingslækkandi áhrif koma ekki fram.
Ramipril og hýdróklórtíazíð einkennast af viðbótaráhrifum. Hýdróklórtíazíð útskolar kalíum úr líkamanum og Ramipril útrýma þessum áhrifum og kemur í veg fyrir tap á K +.
Lyfhrif og lyfjahvörf
Blóðþrýstingslækkandi áhrif Ramipril eru skráð 90 mínútum eftir að pillan var tekin og hámarksárangur sést eftir 5-9 klukkustundir. Áhrifin eru viðvarandi allan daginn. Að lokinni meðferð myndast „fráhvarf“ heilkenni ekki. Þvagræsandi áhrif hýdróklórtíazíðs birtast eftir 1-2 klukkustundir.
Hámarksárangur sést eftir 4 klukkustundir og getur varað í allt að 12 klukkustundir. Blóðþrýstingslækkandi áhrif koma fram eftir 3-4 daga, þó er mögulegt að ná hámarks meðferðaráhrifum aðeins eftir 3-4 vikur.
Aukaverkanir
Hjarta- og æðakerfi:
Æðaæxli:
- minnkað kynhvöt
- próteinmigu
- minnkað þvagmyndun,
- aukin alvarleika einkenna nýrnabilunar.
Taugakerfi:
- taugaveiklun
- blóðþurrðarbreytingar í heila,
- sundl,
- veikleiki
- náladofi
- aukin syfja
- kvíði
- kvíði
- svefntruflanir, svefnleysi,
- tilfinningalegan óstöðugleika,
- yfirlið
- rugl,
- þunglyndi
- skjálfta í útlimum.
Skynfæri:
- breyting á skynjun á smekk,
- sjónskerðing,
- vestibular truflanir
- eyrnasuð.
Meltingarvegur:
Öndunarfæri:
Ofnæmissvör:
- ofsabjúgur í tungu, vörum, barkakýli eða framan á höfði,
- útbrot á húð,
- ofsabjúgur í útlimum,
- serositis
- pemphigus
- Lyells heilkenni
- ljósnæming,
- æðabólga
- exfoliative dermatitis,
- kláði í húð
- ofsakláði
- myositis
- liðagigt
- onycholysis,
- rauðkyrningafæð.
Hematopoietic líffæri:
- blóðfrumnafæð
- blóðrauða minnkun,
- kyrningahrap,
- blóðflagnafæð
- blóðlýsublóðleysi,
- rauðkornavaka.
Hugsanleg áhrif á fóstrið:
- aflögun beina höfuðkúpunnar,
- blóðkalíumlækkun
- greining mótefnavaka,
- blóðnatríumlækkun,
- útlimum samdráttur
- hækkun á blóðþurrð,
- breytingar á starfsemi nýrnakerfisins,
- lækkun blóðþrýstings
- oligohydramnios
- hypoplasia á bein höfuðkúpunnar.
Viðbrögð á rannsóknarstofu:
- greining mótefnavaka,
- blóðkalíumlækkun
- hækkun á blóðþurrð,
- blóðkreatininemia,
- hækkun á bilirubinemia
- aukið ALT, AST, bilirubin.
Önnur viðbrögð:
Neikvæð viðbrögð sem einkenna hýdróklórtíazíð:
- hjartsláttartruflanir,
- pirringur
- rugl,
- sveigjanleiki sálarinnar og skapið,
- blóðklóríð basa,
- niðurgangsheilkenni
- gallblöðrubólga
- hraðtaktur,
- blóðleysi (aplastic, hemolytic),
- réttstöðuþrýstingsfall,
- epigastric verkur
- sialadenitis
- brisbólga
- lystarleysi
- blóðþurrð í blóði
- blóðsykurshækkun
- versnun þvagsýrugigt
- drepandi æðabólga,
- útbrot á húð,
- lungnabólga
- lungnabjúgur sem ekki er hjartasjúkdómur.
Leiðbeiningar um Tritac Plus (aðferð og skammtur)
Skömmtun fer fram með hliðsjón af einstökum einkennum. Mælt er með móttökutíma á morgnana. Hámarks leyfilegt á dag er að taka 2 töflur í 5 + 25 eða 4 töflum í 2,5 + 12,5 skammti, sem samsvarar 50 mg af hýdróklórtíazíði og 10 mg af Ramipril.
Þegar þeir sleppa skammti reyna þeir að taka hann eins fljótt og auðið er. Sjálf tvöföldun skammtsins er ekki leyfð. Töflurnar þarf að þvo niður með vatni, það er ekki leyfilegt að brjóta og tyggja. Borða hefur ekki áhrif á alvarleika meðferðaráhrifa Tritace Plus.
Notist á meðgöngu og meðan á brjóstagjöf stendur
Ekki ætti að nota Tritace ® Plus á meðgöngu. Þess vegna ætti að útiloka þungun áður en lyfið er tekið hjá konum á æxlunaraldri og meðan á meðferð stendur ætti að nota áreiðanlegar getnaðarvarnir. Ef þungun kemur fram meðan á meðferð með lyfinu stendur, þá ættir þú að hætta að taka það eins fljótt og auðið er og flytja sjúklinginn á að taka önnur blóðþrýstingslækkandi lyf, þar sem áhættan fyrir barnið er sem minnst.
Vegna hættu á skaðlegum áhrifum ramipril og hýdróklórtíazíðs á fóstrið er mælt með því að konum sem ekki er hægt að flytja í aðra meðferð vegna háþrýstings (án ACE hemla og þvagræsilyfja) sé ráðlagt að forðast getnað.
Ekki er vitað hvort áhrif lyfsins Tritace ® Plus á fyrsta þriðjungi meðgöngu geta haft neikvæð áhrif á þroska fósturs. Notkun ACE hemla á öðrum og þriðja þriðjungi meðgöngu er ásamt sjúkdómum sem geta komið fram hjá fóstri og nýburum, þar með talið lækkaður blóðþrýstingur, blóðþéttni í heila bein, þvagþurrð, afturkræfur eða óafturkræfur nýrnabilun og dauði.
Einnig var greint frá þroska oligohydramnios, greinilega vegna versnunar á starfsemi nýrna fósturs, oligohydramnios í slíkum tilvikum fylgdi þróun samdráttar í útlimum fósturs, vansköpun í fæðingu, ótímabær fæðing, vöðvasöfnun í legi og ekki lokun botnfrumna (hvort sem það er vitað hvort ekki væri vitað, þessi áhrif eru áhrif ACE hemils.
Mælt er með því að fylgjast vandlega með nýburum sem voru útsettir fyrir völdum ACE hemla í legi til að greina lækkun á blóðþrýstingi, oliguria og blóðkalíumlækkun. Í oliguria er nauðsynlegt að viðhalda blóðþrýstingi og flæði um nýru með því að setja viðeigandi vökva og æðaþrengandi lyf. Slík nýburar eru í hættu á að fá oliguria og taugasjúkdóma, vegna hugsanlegrar lækkunar á blóðflæði um nýru og heila vegna lækkunar á blóðþrýstingi af völdum ACE hemla. Gert er ráð fyrir að með notkun hýdróklórtíazíðs á öðrum þriðjungi meðgöngu sé þróun blóðflagnafæðar hjá nýburum möguleg.
Brjóstagjöf
Þar sem ramipril og hýdróklórtíazíð skiljast út í brjóstamjólk, ef nauðsynlegt er að nota lyfið Tritace plus meðan á brjóstagjöf stendur, ætti að hætta brjóstagjöf.
Skammtar og lyfjagjöf
Aðferð við notkun
Gleypa skal töflurnar heilar með nægilegu magni af vatni (1/2 bolli). Ekki er hægt að mylja og tyggja töflur. Borða hefur ekki marktæk áhrif á aðgengi lyfsins, svo það er hægt að taka það fyrir, meðan eða eftir máltíð. Venjulega er mælt með því að dagskammturinn sé tekinn einu sinni á sama tíma dags, aðallega á morgnana.
Mælt er með skömmtum og skömmtum skömmtum
Skammtar lyfsins eru valdir hver fyrir sig. Val á skömmtum er framkvæmt af lækni í samræmi við alvarleika slagæðarháþrýstings og tilvist tilheyrandi áhættuþátta, sem og þol gagnvart lyfinu.
Skammtur Tritace plús lyfsins er valinn með títrun (smám saman aukning eða, ef nauðsyn krefur, lækkun) á skömmtum einstakra ramipríls og hýdróklórtíazíð efnablöndna. Skammtaaðlögun ætti að vera sérstaklega varkár hjá sjúklingum sem eru í blóðskilun.
Eftir að sjúklingur hefur verið valinn skammtur af ramipril og hýdróklórtíazíði, til að auðvelda sjúklingum, er hægt að skipta um inntöku þeirra með því að taka lyfið Tritace ásamt viðeigandi skammti, til að tryggja að þessir skammtar af ramipril og hýdróklórtíazíði séu teknir í einni töflu.
Venjulegur upphafsskammtur: 2,5 mg ramipril og 12,5 mg hýdróklórtíazíð einu sinni á dag. Ef nauðsyn krefur getur skammturinn aukist með 2-3 vikna millibili.
Hjá sjúklingum sem ekki geta náð nauðsynlegri blóðþrýstingslækkun með einlyfjameðferð með ramiprili í 10 mg skammti, eða hjá sjúklingum sem hafa nauðsynlega blóðþrýstingslækkun sem náðst hefur með ramipril í 10 mg skammti og hýdróklórtíazíði í skömmtum 12,5 mg -25 mg sem aðskildar efnablöndur er mögulegt að nota lyfið Tritace plus 12,5 mg + 10 mg og 25 mg + 10 mg.
Í flestum tilvikum lækkar blóðþrýstingur nægjanlega þegar Tritace ® Plus er tekið í skömmtum frá 2,5 mg af ramipril og 12,5 mg af hýdróklórtíazíði í 5 mg af ramipril og 25 mg af hýdróklórtíazíði. Ráðlagðir skammtar og skammtaáætlun við sérstakar klínískar aðstæður
Meðferð sjúklinga sem fá þvagræsilyf
Sjúklingum sem hafa fengið fyrri meðferð með þvagræsilyfjum, áður en þeir taka lyfið Tritace plus, ef mögulegt er í 2-3 daga eða fleiri (fer eftir lengd verkunar þvagræsilyfja), ætti að hætta þeim eða að minnsta kosti minnka skammtinn.
Ef ekki er mögulegt að hætta notkun þvagræsilyfja er mælt með því að hefja meðferð með lægstu skömmtum af ramipríli (1,25 mg á dag) í þessari samsetningu og taka aðskilin lyf af ramipril og hýdróklórtíazíði. Mælt er með því að í framtíðinni ætti að fara yfir í að taka Tritace ® plús þannig að upphafsdagskammtur fari ekki yfir 2,5 mg af ramipríli og 12,5 mg af hýdróklórtíazíði. Meðferð sjúklinga með skerta nýrnastarfsemi
Þegar úthreinsun kreatíníns er frá 30 til 60 ml / mín. Á 1,73 m2 líkamsyfirborðs byrjar meðferð með einlyfjameðferð með ramipril í daglegum skammti, 1,25 mg.
Eftir smám saman aukningu á skammti ramipríls byrjar meðferð með samsettri lyfjameðferð með 2,5 mg skammti af ramipríli og 12,5 mg af hýdróklórtíazíði. Hámarks leyfilegi dagskammtur fyrir sjúklinga með nýrnabilun er 5 mg ramipril og 25 mg hýdróklórtíazíð. Slíkir sjúklingar ættu ekki að taka Tritace ® töflur auk 12,5 mg + 10 mg og 25 mg + 10 mg.
Meðferð sjúklinga með væga (5-6 stig á Child-Pyo kvarðanum) eða í meðallagi (7-9 stig á Child-Pyo kvarðanum) skerta lifrarstarfsemi
Meðferð með Tritace ® plús ætti að hefjast undir nánu eftirliti læknis og hámarks dagsskammtur af ramiprili ætti að vera 2,5 mg.
Hjá slíkum sjúklingum er ekki hægt að nota Tritace ® töflur, auk 25 mg + 5 mg, 12,5 + 10 mg 25 mg + 10 mg.
Meðferð aldraðra
Meðferð ætti að byrja með lægri skömmtum og aukning á skömmtum ætti að vera smám saman (með minni skammtaaukningu) vegna meiri líkur á aukaverkunum, sérstaklega hjá veiktum öldruðum sjúklingum.
Skammta sleppa
Þegar næsta skammt er sleppt skal taka skammtinn sem gleymdist eins fljótt og auðið er. Hins vegar, ef þetta finnst mjög nálægt tíma næsta skammts, er nauðsynlegt að sleppa skammtinum sem gleymdist og fara aftur í venjulega skammtaáætlun og forðast að tvöfalda skammtinn á stuttum tíma.
Aukaverkanir
Eftirfarandi eru aukaverkanir sem geta komið fram við notkun Tritace ® plús, virku efnin þess (ramipril og hýdróklórtíazíð), aðrir ACE hemlar eða önnur þvagræsilyf eins og hýdróklórtíazíð, sem eru gefin í samræmi við eftirfarandi stig á tíðni tíðni þeirra:
mjög oft (≥ 10%), oft (≥ 1% - Hjartasjúkdómar
Sjaldan: hjartaþurrð í hjartavöðva, þ.mt þróun hjartaöng, hraðtaktur, hjartsláttartruflanir, hjartsláttarónot, útlægur bjúgur.
Óþekkt tíðni: hjartadrep.
Truflanir í blóði og eitlum
Sjaldan: fækkun hvítfrumna í útlægum blóði, fækkun rauðra blóðkorna í útlæga blóði, fækkun blóðrauða, blóðlýsublóðleysi, fækkun blóðflagna í útlæga blóði.
Óþekkt tíðni: brot á beinmergsblóðfælni, þar með talið kyrningafjölgun (mikil lækkun eða hvarf granulocytes úr útlægum blóði), brisfrumnafæð, rauðkyrningafæð, blæðing í blóði vegna lækkunar á vökvainnihaldi í líkamanum, þar með talið útlæga blóði.
Truflanir í taugakerfinu
Oft: höfuðverkur, sundl (tilfinning um „léttleika“ í höfðinu).
Sjaldan: svimi, náladofi, skjálfti, ójafnvægi, brennandi tilfinning húðarinnar, bráðaofnæmi (bragð á bragði), agegezia (bragðleysi).
Óþekkt tíðni: heilablóðþurrð, þar með talið blóðþurrðarslag og tímabundin truflun á heilarás, skert skynhreyfingarviðbrögð, parosmia (skert lykt, þ.mt huglæg tilfinning hvers lyktar í fjarveru).
Brot á sjónlíffæri
Sjaldan: sjóntruflanir, þ.mt óskýrleiki sýnilegs myndar, tárubólga.
Óþekkt tíðni: xantopsia, samdráttur í framleiðslu tárvökva (vegna nærveru hýdróklórtíazíðs í efnablöndunni).
Heyrnarskerðing og völundarhúsasjúkdómar
Sjaldan: hringir í eyrunum.
Óþekkt tíðni: heyrnartap.
Truflanir í öndunarfærum, brjósti og miðmæti
Oft: óafleiðandi („þurr“) hósti, berkjubólga.
Sjaldan: skútabólga, mæði, nefstífla.
Óþekkt tíðni: berkjukrampar, þar með talin aukin einkenni berkjuastma, ofnæmisbólga (lungnabólga), lungnabjúgur sem ekki eru hjartalínurit (vegna nærveru hýdróklórtíazíðs í efnablöndunni).
Meltingarfæri
Sjaldan: bólguviðbrögð slímhúðar í meltingarvegi, meltingartruflanir, óþægindi í kvið, meltingartruflanir, magabólga, ógleði, hægðatregða, tannholdsbólga (vegna nærveru hýdróklórtíazíðs í efnablöndunni).
Örsjaldan: uppköst, aphthous munnbólga, glárubólga, niðurgangur, kviðverkir, þurr slímhúð í munni.
Óþekkt tíðni: brisbólga (í undantekningartilvikum, þegar ACE-hemlar voru teknir, sást banvæn brisbólga), aukin virkni brisiensíma í blóði, ofsabjúgur í smáþörmum, sialadenitis (vegna nærveru hýdróklórtíazíðs í blöndunni).
Brot á nýrum og þvagfærum
Sjaldan: skert nýrnastarfsemi, þ.mt bráð nýrnabilun, aukning á þvagi sem skilst út, aukning á styrk þvagefnis í blóði, aukning á styrk kreatíníns í blóði (jafnvel lítilsháttar aukning á styrk kreatiníns með einhliða nýrnaslagæðarþrengsli getur bent til skert nýrnastarfsemi).
Óþekkt tíðni: aukin próteinmigu, millivefsbólga nýrnabólga (vegna nærveru hýdróklórtíazíðs í efnablöndunni).
Truflanir á húð og undirhúð
Sjaldan: ofsabjúgur: í undantekningartilvikum getur hindrun á öndunarvegi vegna ofsabjúgs leitt til dauða, psoriasis-lík húðbólga, aukin svitamyndun, útbrot í húð, einkum útbrot á papular húð, kláða, sköllótt.
Óþekkt tíðni: eitrað drep í húðþekju, Stevens-Johnson heilkenni, rauðkornamyndun, pemphigus, versnun psoriasis, exfoliative húðbólga, ljósnæmisviðbrögð, onycholysis, pemphigoid eða fljúgandi exanthema eða ofþemba, ofsakláði, altæk rauða úlfa (vegna næmis lyfsins).
Stoðkerfi og stoðvefur
Sjaldan: vöðvaþrá.
Óþekkt tíðni: liðverkir, samdrættir í vöðvum, máttleysi í vöðvum, stífni í vöðvum, tetany (vegna nærveru hýdróklórtíazíðs í blöndunni)
Truflanir frá innkirtlakerfinu
Óþekkt tíðni: heilkenni ófullnægjandi seytingar geðdeyfðarhormóns (SNA ADH).
Efnaskipta- og næringarraskanir
Oft: niðurbrot sykursýki, minnkað glúkósaþol, aukinn styrkur glúkósa í blóði, aukinn styrkur þvagsýru í blóði, aukin einkenni þvagsýrugigtar, aukinn styrkur kólesteróls og þríglýseríða í blóði (vegna nærveru hýdróklórtíazíðs í samsetningunni).
Sjaldan: lystarleysi, minnkuð matarlyst, minnkað kalíum í blóði, þorsti (vegna nærveru hýdróklórtíazíðs í blöndunni).
Mjög sjaldgæfar: aukið kalíum í blóði (vegna nærveru ramipríls í blöndunni).
Óþekkt tíðni: lækkun á natríum í blóði, glúkósúríum, efnaskipta basískri blóðþurrð, blóðklóríðskorti, blóðmagnesíumlækkun, blóðkalsíumlækkun, ofþornun (vegna nærveru hýdróklórtíazíðs í blöndunni)
Æðar
Sjaldan: óhófleg lækkun á blóðþrýstingi, réttstöðuþrýstingsfall (skert stöðubundin stjórnun æðartóni), yfirlið, blóðroði í andlitið.
Óþekkt tíðni: segamyndun með verulegu tapi á vökva, æðaþrengsli, tíðni eða aukinni blóðrásaröskun á bakgrunni æðasjúkdóma í æðum, Raynauds heilkenni, æðabólga.
Almennir kvillar og truflanir á stungustað
Oft: þreyta, þróttleysi.
Sjaldan: brjóstverkur, hiti.
Ónæmiskerfi
Óþekkt tíðni: bráðaofnæmis- eða bráðaofnæmisviðbrögð við ramipríli (með ACE hömlun, aukning alvarlegra bráðaofnæmis eða bráðaofnæmisviðbragða við skordýraeitri er möguleg) eða bráðaofnæmisviðbrögð við hýdróklórtíazíði, sem er aukning á antinuclear mótefnamítra.
Brot á lifur og gallvegi
Sjaldan: gallteppu- eða frumudrepandi lifrarbólga (í undantekningartilvikum með banvænum útkomu), aukning á virkni „lifrarensíma“ og / eða aukning á styrk samtengds bilirúbíns í blóði, skammta gallblöðrubólga (vegna nærveru hýdróklórtíazíðs í blöndunni).
Óþekkt tíðni: bráð lifrarbilun, gallteppu gulu, lifrarfrumuskemmdir.
Brot á kynfærum og brjóstkirtli
Sjaldan: tímabundinn ristruflanir.
Óþekkt tíðni: minnkuð kynhvöt, kvensjúkdómur.
Geðraskanir
Sjaldan: þunglyndi, sinnuleysi, kvíði, taugaveiklun, svefntruflanir (þ.mt syfja).
Óþekkt tíðni: rugl, kvíði, skert athygli (minni styrkur).
Aukaverkanir
Öryggi Ramipril felur í sér viðvarandi þurr hósta og viðbrögð vegna slagæðaþrýstings. Alvarlegar aukaverkanir eru heilablóðfall, hjartadrep, ofsabjúgur, blóðkalíumhækkun, skert nýrna- eða lifrarstarfsemi, brisbólga, viðbrögð í húð og daufkyrningafæð / kyrningahrap.
Algengustu aukaverkanirnar sem greint hefur verið frá við meðferð með amlodipini eru syfja, sundl, höfuðverkur, hraðtaktur, ofhækkun, kviðverkir, ógleði, þroti í ökkla, þroti og aukin þreyta.
Tíðni aukaverkana er flokkuð sem hér segir: mjög oft (≥ 1/10), oft (≥ 1/100 til