Reglugerð um nýmyndun kólesteróls
Reglugerð um nýmyndun kólesteróls - lykilensím þess (HMG-CoA redúktasi) er framkvæmd á mismunandi vegu.
Fosfórýlering / defosfórun á HMG redúktasa. Með hækkun á insúlín / glúkagonhlutfalli fosfórýlýret þetta og berst í virkt ástand. Aðgerð insúlíns fer fram með 2 ensímum.
HMG-CoA redúktasakínasa fosfatasa, sem breytir kínasanum í óvirkt defosfórýlerað ástand:
Phosphotase HMG-CoA redúktasa með því að umbreyta því í defosfórýlerað virkt ástand. Niðurstaðan af þessum viðbrögðum er myndun á defosfórýleruðu virku formi HMG-CoA redúktasa.
Þess vegna, á frásogstímabilinu, eykst kólesteról. Á þessu tímabili eykst framboð upphafs undirlagsins til nýmyndunar kólesteróls - asetýl-CoA (sem afleiðing af því að borða mat sem inniheldur kolvetni og fitu, þar sem CoA asetýl myndast við sundurliðun glúkósa og fitusýra).
Í frásogandi ástandi örvar glúkagon í gegnum próteningenasa A fosfórýleringu HMG - CoA - redúktasa og breytir því í óvirkt ástand. Þessi aðgerð er aukin með því að á sama tíma örvar glúkagon fosfórýleringu og óvirkjun fosfótasa af HMG-CoA redúktasa og heldur þannig HMG-CoA redúktasa í fosfórýleruðu óvirku ástandi. Fyrir vikið er myndun kólesteróls á eftir frásogstímabilinu og meðan á föstu stendur, hamlað með innrænni myndun. Ef kólesterólinnihaldið í matnum var komið í 2% lækkaði myndun innræns kólesteróls verulega. En fullkomin stöðvun kólesterólmyndunar á sér ekki stað.
Hömlun gráðu á nýmyndun kólesteróls undir áhrifum kólesteróls sem kemur frá mat er mismunandi frá manni til manns. Þetta bendir til þess að aðferðin við kólesterólmyndun er einstaklingsbundin. Með því að draga úr styrk kólesterólmyndunar er mögulegt að draga úr styrk þess í blóði.
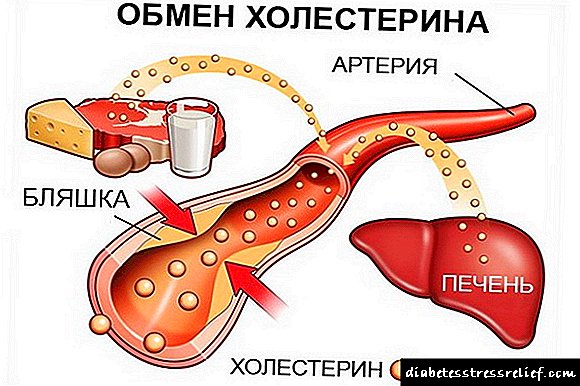
Ef jafnvægið er milli neyslu kólesteróls með mat og myndun þess í líkamanum annars vegar og útskilnað gallsýra og kólesteróls hins vegar, breytist styrkur kólesteróls í vefjum og blóði. Alvarlegustu afleiðingarnar tengjast aukningu á kólesterólstyrk í blóði (kólesterólhækkun) en líkurnar á að fá æðakölkun og gallsteina aukast.
Fjölskyldur kólesterólhækkun (HCS) - þetta form er mun algengara - um það bil 1 sjúklingur á 200 manns. Erfður galli í HCS er brot á frásogi LDL af frumum og því lækkun á tíðni LDL niðurbrots. Fyrir vikið eykst styrkur LDL í blóði, auk kólesteróls þar sem mikið er af því í LDL. Þess vegna, með HCS, er útfelling kólesteróls í vefjum, einkum í húðinni (xanthomas), í veggjum slagæðanna einkennandi.
Hömlun á myndun HMG-CoA redúktasa
Lokaafurðin á efnaskiptaferli kólesteróls. Það dregur úr umritunarhraða HMG-CoA redúktasa geninu og hamlar þannig eigin myndun. Lifrin nýtir virkan gallsýrur úr kólesteróli og þess vegna hamla gallsýrur virkni HMG-CoA redúktasagensins. Þar sem HMG-CoA redúktasi er til eftir myndun um það bil 3, er hömlun á nýmyndun þessa kólesterólensíma skilvirk áhrif.
Fannstu ekki það sem þú varst að leita að? Notaðu leitina:
Kólesteról ester skipti
Kólesterólssjóðurinn inniheldur ókeypis kólesteról og kólesterólester sem finnast bæði í frumum og í lípópróteinum í blóði.
II. Hluti Umbrot og orka
Í frumum gerist esterun kólesteróls með verkun acýl-CoA-kólesteról-asýltransferasa (AChAT):
Acyl-CoA + kólesteról - * HS-KoA + Acylcholesterol
Í frumum manna myndast línóýlkólesteról aðallega. Ólíkt ókeypis kólesteróli, eru esterar þess í frumuhimnum að finna í mjög litlu magni og finnast aðallega í cýtósólinu sem hluti af fitudropum. Myndun estera má annars vegar líta á sem vélbúnað til að fjarlægja umfram kólesteról úr himnunum og hins vegar sem vélbúnaður til geymslu kólesteróls í frumunni. Hreyfing auðlinda fer fram með þátttöku esterasaensíma sem vatnsroða kólesterólester:
Acylcholesterol + H 2O - * Fitusýra + kólesteról
Nýmyndun og vatnsrofi estera fer fram í mörgum frumum, en er sérstaklega virkur í frumum í nýrnahettubarkanum: í þessum frumum er allt að 80% af öllu kólesteróli táknað með estrum, en í öðrum frumum er það venjulega minna en 20%.
Myndun estera í lípónróteinum í blóði fer fram með þátttöku lesitín-kólesteróls asýltransferasa (LHAT), sem hvatar flutning acýlleifa úr i-stöðu lesitíns yfir í kólesteról (mynd 10.31). LHAT myndast í lifrinni, seytt í blóðið og fest við lípóprótein. Esteringarhraði fyrir mismunandi lípóprótein er verulega mismunandi og fer eftir nærveru apólíprópróteina sem virkja LHAT (aðallega apo-AT, svo og CI) eða hindra (C-II) þetta ensím. Virkasta LHAT í HDL, þar sem apo-AT þarf að Olee 2/3 af öllum próteinum. Stærstu coli virðir myndast við estera af olíusýru- og línólsýru sýrur. Önnur fituprótín Ester mvndun á sér stað með minni hraða en í HDL.
Mynd. 10.31. Myndun kólesteról estera undir verkun LHAT
LHAT er staðbundið í yfirborðslagi HDL og notar kólesteról í fosfólípíð einlaginu sem undirlag. Kólesterólesterarnir sem myndast hér, vegna fullkominnar vatnsfælni, eru illa haldnir í
10. kafli. Umbrot og lípíðvirkni
fosfólípíð einlaga og sökkt í fitukjarna fitupróteinsins. Á sama tíma losnar staður fyrir kólesteról í fosfólípíð einlaginu, sem hægt er að fylla með kólesteróli úr frumuhimnum eða öðrum lípópróteinum. Þannig virðist HDL vera kólesterólgildra vegna verkunar LHAT.
Gallsýrumyndun
Í lifur er hluta af kólesterólinu breytt í gallsýrur. Hægt er að líta á gallsýrur sem afleiður kólansýru (mynd 10.32).
Kólansýra sem slík myndast ekki í líkamanum. Í lifrarfrumum framleiðir kólesteról beint chenodeoxycholic og kólínsýrur - aðal gallsýrur (mynd 10.33, sjá einnig mynd 10.12).
Lífsgerving kólesteróls
Lífsgerving kólesteróls á sér stað í endoplasmic reticulum. Uppruni allra kolefnisatóma í sameindinni er asetýl-SCoA, sem kemur hingað frá hvatberum sem hluti af sítrati, eins og í myndun fitusýra. Lífsgerving kólesterólsins eyðir 18 ATP sameindir og 13 NADPH sameindir.
Myndun kólesteróls á sér stað í meira en 30 viðbrögðum, sem hægt er að flokka í nokkur stig.
1. Samsetning mevalonsýru.
Fyrstu tvö myndunarviðbrögðin falla saman við ketogenesisviðbrögðin, en eftir myndun 3-hýdroxý-3-metýlglutaryl-ScoA fer ensímið inn hýdroxýmetýl-glútarýl-ScoA redúktasa (HMG-SCOA redúktasi), myndar mevalonsýru.
 |
Viðbrögð fyrir kólesterólmyndun2. Tilmyndun ísóprentenýlfosfats. Á þessu stigi eru þrjár fosfatleifar festar við mevalonsýru, síðan er það afkassboxýlerað og afvetnt. 3. Eftir að sameindir þriggja sameindanna af ísópentenýl tvífosfati eru farnesýl tvífosfat samstillt. 4. Tilmyndun skvalens á sér stað þegar tvær farnesýl tvífosfat leifar eru bundnar. 5. Eftir flókin viðbrögð, hleðst línuleg skvalen yfir í lanósteról. 6. Fjarlæging umfram metýlhópa, endurreisn og samsöfnun sameindarinnar leiðir til kólesteróls. Reglugerð um virkni hýdroxýmetýlglutaryl-S-CoA redúktasa3. Hraði myndunar kólesteróls fer einnig eftir styrk sértækt burðarpróteinsem kveður á um bindingu og flutning vatnsfælna milligöngu umbrotsefna. Þú getur spurt eða látið álit þitt. Aðalatriðið í reglugerð er viðbrögð myndunar mevalonsýru. 1. Alosteric reglugerð. Kólesteról og í lifur - og gallsýrur hindra HMG-CoA redúktasa. 2. Kúgun myndunar HMG-CoA redúktasa kólesteróls. 3. Reglugerð með fosfórýleringu-fosfórýleringu af HMG-CoA redúktasa, virku ekki fosfórýleruðu formi. Glúkagon veldur óvirkingu og insúlín veldur virkjun í gegnum flókna viðbragðshröð. Þannig breytist tíðni nýmyndunar kólesteróls með breytingu á frásogandi og eftir frásogastöðu. 4. Hraði nýmyndunar HMG-CoA redúktasa í lifur er háð skýrum daglegum sveiflum: hámarki á miðnætti og lágmark að morgni. Kólesteról ester skipti Í frumunum estrering kólesteróls á sér stað þegar hún verður fyrir asýl-CoA-kólesteról-asýltransferasa (AHAT): Acyl-CoA + Cholesterol ® NS-CoA + Acylcholesterol Í frumum myndast aðallega línóleýlkólesteról. Estera er aðallega að finna í cýtósólinu sem hluti af fitudropum. Myndun estera má annars vegar líta á sem vélbúnað til að fjarlægja umfram kólesteról úr himnunum, og hins vegar sem vélbúnaður til að geyma kólesteról í frumunni. Að virkja forða fer fram með þátttöku ensíma esterasavatnsrof kólesteról estera: Acylcholesterol + N2O ® fitusýra + kólesteról Nýmyndun og vatnsrof estera er sérstaklega virk í frumum nýrnahettubarkarins. Hjá lípópróteinum í blóði estermyndun á sér stað með þátttöku lesitín-kólesteról-asýltransferasa (LHAT) sem hvetur flutning á asýlleifinni frá lesitíni yfir í kólesteról. LHAT myndast í lifur, seytt í blóðrásina og fest við lípóprótein. Virkasta LHAT í HDL, þar sem það er staðsett í yfirborðslaginu. Kólesterólesterarnir sem myndast hér eru vatnsfælin og sökkt í fitukjarna. Í fosfólípíð einlaga laginu er laust pláss fyrir kólesteról, sem hægt er að fylla með kólesteróli úr frumuhimnum eða öðrum lípópróteinum. Þannig virðist HDL vera kólesterólgildra vegna verkunar LHAT. Gallsýrumyndun Í lifur er hluta af kólesterólinu breytt í gallsýrur. Tala má gallsýrur sem afleiður kólansýru. Kólansýra sem slík myndast ekki í líkamanum. Í lifrarfrumum úr kólesteróli myndast frumgallsýrur - chenodeoxycholic og kólískt. Eftir að galli seytist út í þörmum undir verkun ensíma í þarmaflórunni myndast auka gallsýrur úr þeim - litologic og deoxycholic. Þeir frásogast úr þörmunum, með blóði í bláæðaræðinni inn í lifur og síðan í gallinn. Gall inniheldur aðallega samtengdar gallsýrur, þ.e.a.s. efnasambönd þeirra með glýsíni eða tauríni. Styrkur gallsýra í galli er um 1%. Uppistaðan í gallsýrum tekur þátt í blóðrás í lifur.Lítill hluti gallsýra - um það bil 0,5 g á dag - skilst út í hægðum. Þetta er bætt upp með nýmyndun nýrra gallsýra í lifur, gallsýrusjóðurinn er uppfærður á um það bil 10 dögum. Kólesteról skilst einnig út aðallega í þörmum. Það fer í þörmum með mat og úr lifrinni sem hluti af galli. Kólesteról sem frásogast í blóðið inniheldur brot sem er upprunnið úr galli (innræn kólesteróltilbúið í lifur), og brotið sem fæst úr mat (utanaðkomandi kólesteról) Fjarlæging kólesteróls úr vefjum á sér stað með því að oxa það í gallsýrur í lifur, síðan er útskilnað með saur (u.þ.b. 0,5 g á dag) og með því að skilja óbreytt kólesteról út (einnig með hægðum). Í kyrrstöðu: (Kólesterólenda + Kólesterólfyrrv) - (Kólesterólexcre + Gallsýrurexcre) = 0 Ef þessu jafnvægi er raskað breytist styrkur kólesteróls í vefjum og í blóði. Hækkað kólesteról í blóði - kólesterólhækkun. Þetta eykur líkurnar á æðakölkun og gallsteinssjúkdómi. LIPID REGLUGERÐ Lípíð umbrot stjórnast af miðtaugakerfinu. Langvarandi neikvætt tilfinningalegt álag, aukning á losun katekólamína í blóðrásina getur valdið áberandi þyngdartapi. Aðgerð glúkagon á fitusjúkdómakerfinu er svipað og verkun katekólamína. Adrenalín og noradrenalín auka virkni lípasa í vefjum og hraða fitusýni í fituvef, þar af leiðandi eykst innihald fitusýra í blóðvökva í blóði. Insúlín hefur öfug áhrif adrenalíns og glúkagons á fitusundrun og virkjun fitusýra. Vaxtarhormón örvar fitusækni og örvar myndun asenýlatsýklasa. Hypofunction heiladinguls leiðir til þess að fita er sett í líkamann (offitu í heiladingli). Týroxín, kynhormónhefur einnig áhrif á umbrot lípíðs. Að fjarlægja kynkirtla í dýrum veldur umframfitufitu. LIPID METABOLIC STOFNIR Kólesteról er steri sem er sértækur fyrir lífverur. Aðalstaður myndunar þess í mannslíkamanum er lifrin, þar sem 50% kólesteróls er búið til, 15–20% myndast í smáþörmum, afgangurinn er búinn til í húð, nýrnahettubarkar og kynkirtla. Uppruni um myndun kólesterólssjóðsins og leiðir til útgjalda hans eru settar fram á mynd 22.1. Mynd. 22.1. Myndun og dreifing kólesteróls í líkamanum. Skipta má kólesteróli mannslíkamans (heildarmagn um það bil 140 g) í þrjár laugar: 30 g), skiptast hratt saman, samanstendur af kólesteróli í þörmum, blóðvökva, lifur og öðrum líffæraþörungum, endurnýjun á sér stað í 30 daga (1 g / dag) 50 g), skiptast rólega á kólesteróli í öðrum líffærum og vefjum, 60 g), mjög hægt að skipta um kólesteról í mænu og heila, bandvef, uppfærsluhlutfallið er reiknað út í gegnum árin. Nýmyndun kólesteróls fer fram í cýtósóli frumna. Þetta er einn af lengstu efnaskiptaferlum mannslíkamans. Það heldur áfram í 3 áföngum: fyrsta endar með myndun mevalonsýru, seinni með myndun skvalens (línuleg kolvetnisbygging sem samanstendur af 30 kolefnisatómum). Á þriðja stigi er squalen breytt í lanosterol sameind, þá eru 20 viðbrögð í röð sem umbreyta lanosterol í kólesteról. Í sumum vefjum estrar hýdroxýl hópur kólesteróls og myndar estera. Viðbrögðin eru hvötuð af innanfrumuensíminu AHAT (acylCoA: kólesteról asýltransferasa). Estrunarviðbrögð koma einnig fram í blóði í HDL, þar sem ensímið LHAT (lesitín: kólesteról asýltransferasi) er staðsett. Kólesterólesterar eru það form sem það er flutt með blóði eða sett í frumur. Í blóði eru um 75% af kólesteróli á formi estera. Kólesterólmyndun er stjórnað með því að hafa áhrif á virkni og magn lykilensímsins í ferlinu - 3-hýdroxý-3-metýlglutaryl-CoA redúktasa (HMG-CoA redúktasi). Þetta er náð á tvo vegu: 1. Fosfórýlering / defosfórun á HMG-CoA redúktasa. Insúlín örvar fosfórýleringu HMG-CoA redúktasa og þýðir það þar með í virkt ástand. Þess vegna eykur myndun kólesteróls á frásogstímabilinu. Á þessu tímabili eykst einnig framboð upphafs undirlagsins fyrir nýmyndun, asetýl-CoA. Glúkagon hefur þveröfug áhrif: með próteinkínasa A örvar það fosfórýleringu HMG-CoA redúktasa og breytir því í óvirkt ástand. Afleiðingin er að myndun kólesteróls á eftir frásogstímabilinu og meðan á föstu stendur. 2. Hömlun á myndun HMG-CoA redúktasa.Kólesteról (lokaafurð efnaskiptaferilsins) dregur úr umritunarhraða HMG-CoA redúktasagensins og hindrar þannig eigin myndun og gallsýrur valda einnig svipuðum áhrifum. Flutningur á kólesteróli í blóði fer fram sem hluti af lyfinu. LP veita exogent kólesteról í vefjum, ákvarða flæði þess milli líffæra og útskilnað frá líkamanum. Framandi kólesteról er skilað í lifur sem hluti af leifar af ChM. Þar myndar það, ásamt tilbúnu innrænu kólesteróli, sameiginlegum sjóði. Í lifrarfrumum er TAGs og kólesteról pakkað í VLDL og á þessu formi skilin út í blóðið. Undir áhrifum LP-lípasa, vatnsrofi TAG í glýseról og fitusýrur í blóði, er VLDLP fyrst breytt í STLP og síðan í LDLP sem innihalda allt að 55% af kólesteróli og estera þess. LDL er aðal flutningsform kólesteróls sem það berst í vefi (70% af kólesteróli og esterar þess í blóði eru hluti af LDL). LDL úr blóði fer í lifur (allt að 75%) og aðrir vefir sem eru með LDL viðtaka á yfirborði sínu. Ef magn kólesteróls sem fer í frumuna er meiri en þörf þess, þá er nýmyndun LDL viðtaka bæld, sem dregur úr flæði kólesteróls úr blóði. Með lækkun á styrk ókeypis kólesteróls í frumunni er þvert á móti virkja myndun viðtaka. Hormón taka þátt í stjórnun á nýmyndun LDL viðtakanna: insúlín, þríiodothyronine og kynhormón auka myndun viðtaka og sykurstera minnkar. Í svokölluðum „kólesteról afturflutningi“, þ.e.a.s. leiðin sem tryggir aftur kólesteról í lifur, HDL leikur aðalhlutverkið. Þeir eru búnir til í lifur í formi óþroskaðra forvera sem innihalda nánast ekki kólesteról og TAG. Forvera HDL í blóði eru mettuð með kólesteróli og fá það frá öðrum LP og frumuhimnum. Flutningur kólesteróls til HDL felur í sér LHAT ensímið sem staðsett er á yfirborði þeirra. Þetta ensím festir fitusýru leifar af fosfatidýlkólíni (lesitíni) við kólesteról. Fyrir vikið myndast vatnsfælin sameind kólesterólester sem hreyfist inni í HDL. Þannig að ekki drukkinn HDL, auðgaður með kólesteróli, breytist í HDL 3 - þroskaðar og stærri agnir. HDL 3 skiptast á kólesterólesterum fyrir TAG sem er að finna í VLDL og STD með þátttöku sérstaks próteins sem flytur kólesterólester milli lípópróteina. Í þessu tilfelli, HDL 3 breytast í HDL2, sem stærðin eykst vegna uppsöfnunar TAG. VLDL og STDL undir áhrifum LP-lípasa er breytt í LDL sem skila aðallega kólesteróli í lifur. Lítill hluti kólesteróls er borinn í lifur HDL2 og HDL. Tilmyndun gallsýra. Í lifur eru 500–700 mg gallsýrur á dag samstilltar úr kólesteróli. Myndun þeirra felur í sér viðbrögð við tilkomu hýdroxýlhópa með þátttöku hýdroxýlasa og viðbrögðum hluta oxunar á hliðarkeðju kólesteróls (mynd 22.2): Mynd. 22.2. Fyrirætlun um myndun gallsýra. Fyrstu myndunarviðbrögðin - myndun 7-a-hýdroxýkólesteról - eru reglur. Virkni ensímsins sem hvatar þessi viðbrögð er hindruð af lokafurð ferilsins, gallsýrur. Annar stjórnunarbúnaður er fosfórýlering / defosfórun ensímsins (fosfórýlerað form 7-a-hýdroxýlasa er virkt). Reglugerð er einnig möguleg með því að breyta magni ensímsins: kólesteról örvar umritun 7-a-hýdroxýlasasgensins og gallsýrur bæla niður. Skjaldkirtilshormón örvar myndun 7-a-hýdroxýlasa og estrógen kúgun. Slík áhrif estrógena á myndun gallsýra skýrir hvers vegna gallsteinssjúkdómur kemur fram hjá konum 3-4 sinnum oftar en hjá körlum. Kólín og chenodeoxycholic sýrur myndaðar úr kólesteróli eru kallaðar „aðal gallsýrur“. Megnið af þessum sýrum verður fyrir samtengingu - viðbót glýsíns eða taurínsameinda við karboxýlhóp gallsýru. Samtenging byrjar á myndun virks forms gallsýra - afleiður af CoA, síðan eru taurín eða glýsín fest og þar af leiðandi myndast 4 afbrigði af samtengdum: taurocholic og taurohenodeoxycholic, glycocholic og glycohenodeoxycholic sýrum. Þau eru verulega sterkari ýruefni en upphaflegu gallsýrurnar. Samtengingar með glýsíni myndast þrisvar sinnum meira en með tauríni, þar sem magn tauríns í líkamanum er takmarkað. Í þörmum er litlu magni af samtengdum frumgallsýrum undir verkun bakteríumensíma breytt í efri gallsýrur. Deoxycholic sýra, mynduð úr kólikó, og litocholic, mynduð úr deoxycholic, eru minna leysanleg og frásogast hægt í þörmum. Um það bil 95% gallsýra sem fara í þörmum fara aftur í lifur í gegnum bláæðaræðina og eru síðan seytt út í gallið og endurnýtt í fleyti fitu. Þessi leið gallsýra er kölluð meltingarfærasjúkdómur. Með saur eru aðallega gallsýrur að mestu fjarlægðar. Gallsteinssjúkdómur (gallsteinarhjúpur) er meinafræðilegt ferli þar sem steinar myndast í gallblöðru, undirstaða þess er kólesteról. Losun kólesteróls í galli ætti að fylgja hlutfallslegri losun á gallsýrum og fosfólípíðum sem halda vatnsfælnum kólesteról sameindum í micellar ástandi. Ástæðurnar sem leiða til breytinga á hlutfalli gallsýra og kólesteróls í galli eru: Matur sem er ríkur í kólesteróli, næring með kaloríu, stöðnun galls í gallblöðru, skert meltingarfærasjúkdómur, skert myndun gallsýra, gallblöðru sýking. Hjá flestum sjúklingum með gallsteina eykst nýmyndun kólesteróls og hægir á myndun gallsýra úr því, sem leiðir til óhófs í magni kólesteróls og gallsýra sem seytt er í gallinn. Fyrir vikið byrjar kólesteról að falla í gallblöðru og myndar seigfljótandi botnfall sem smám saman harðnar. Stundum er það gegndreypt með bilirubin, próteinum og kalsíumsöltum. Steinar geta aðeins samanstendur af kólesteróli (kólesterólsteinum) eða blöndu af kólesteróli, bilirubini, próteinum og kalsíum. Kólesterólsteinar eru venjulega hvítir og blandaðir steinar eru brúnir í mismunandi tónum. Á fyrsta stigi steinsmyndunar er hægt að nota chenodeoxycholic sýru sem lyf. Einu sinni í gallblöðru leysir það kólesterólsteina smám saman upp, en þetta er hægt ferli sem stendur í nokkra mánuði. Æðakölkun er meinafræði sem einkennist af útliti æðakúða á innra yfirborði æðarveggsins. Ein meginástæðan fyrir þróun slíkrar meinafræði er brot á jafnvægi milli inntöku kólesteróls úr mat, myndun þess og útskilnaðar frá líkamanum. Sjúklingar með æðakölkun hafa hækkað LDL og VLDL styrk. Andstætt samband er á milli HDL styrks og líkurnar á að fá æðakölkun. Þetta er í samræmi við hugmyndina um virkni LDL sem burðarefna kólesteróls í vefjum og HDL frá vefjum. Grunn efnaskipti „forsenda“ fyrir þróun æðakölkun er kólesterólhækkun. (hátt kólesteról í blóði). Kólesterólhækkun myndast: 1. vegna umframneyslu kólesteróls, kolvetna og fitu, 2. erfðafræðileg tilhneiging sem samanstendur af arfgengum göllum í uppbyggingu LDL- eða apoB-100 viðtaka, sem og í aukinni myndun eða seytingu apoB-100 (þegar um er að ræða fjölskyldusamsettan blóðfituhækkun, þar sem styrkur blóðs og kólesteról og TAG er hækkaður). Mikilvægt hlutverk í fyrirkomulagi þróunar æðakölkun fer með breytingu lyfsins. Breytingar á eðlilegri uppbyggingu lípíða og próteina í LDL gera þær aðskildar fyrir líkamann og því aðgengilegri fyrir handtaka með fagfrumum. Lyfjameðferð getur átt sér stað með nokkrum aðferðum: 1. glýkósýleringu próteina sem á sér stað þegar styrkur glúkósa í blóði eykst, 2. peroxíðbreyting, sem leiðir til breytinga á lípíðum í lípópróteinum og uppbyggingu apoB-100, 3. myndun sjálfsofnæmisfléttna LP-mótefnisins (breytt lyf geta valdið myndun sjálfsmótefna). Breytt LDL frásogast af átfrumum. Þessu ferli er ekki stjórnað af magni kólesteróls sem frásogast, eins og þegar það fer inn í frumur í gegnum tiltekna viðtaka, þess vegna eru átfrumur ofhlaðnir kólesteróli og breytast í „froðufrumur“ sem komast inn í undirheima rýmið. Þetta leiðir til myndunar lípíðbletti eða ræma í vegg æðum. Á þessu stigi getur æðaþelið haldið uppbyggingu. Með fjölgun froðufrumna verður skemmdir á æðaþels. Skemmdir stuðla að virkjun blóðflagna. Afleiðingin er sú að þau seyta trómboxan, sem örvar samloðun blóðflagna og byrja einnig að framleiða vaxtarþátt blóðflagna, sem örvar fjölgun sléttra vöðvafrumna. Hinn síðarnefndi flytur frá miðli yfir í innra lag slagæðarveggsins og stuðlar þannig að vexti veggskjaldsins. Þá spíra veggskjöldur með trefjavef, frumurnar undir trefjahimnunni eru drepkyrrðar og kólesteról er komið fyrir í millfrumu rýminu. Á síðustu stigum þróunarinnar er veggskjöldur gegndreyptur með kalsíumsöltum og verður mjög þéttur. Á svæðinu á veggskjöldunni myndast oft blóðtappar sem hindra holrými skipsins, sem leiðir til bráðrar truflunar á blóðrás á samsvarandi vefjum og þróun hjartaáfalls. Reglugerð um nýmyndun kólesteróls - lykilensím þess (HMG-CoA redúktasi) er framkvæmd á mismunandi vegu. Fosfórýlering / defosfórun á HMG redúktasa. Með hækkun á insúlín / glúkagonhlutfalli fosfórýlýret þetta og berst í virkt ástand. Aðgerð insúlíns fer fram með 2 ensímum. HMG-CoA redúktasakínasa fosfatasa, sem breytir kínasanum í óvirkt defosfórýlerað ástand: Phosphotase HMG-CoA redúktasa með því að umbreyta því í defosfórýlerað virkt ástand. Niðurstaðan af þessum viðbrögðum er myndun á defosfórýleruðu virku formi HMG-CoA redúktasa. Þess vegna, á frásogstímabilinu, eykst kólesteról. Á þessu tímabili eykst framboð upphafs undirlagsins til nýmyndunar kólesteróls - asetýl-CoA (sem afleiðing af því að borða mat sem inniheldur kolvetni og fitu, þar sem CoA asetýl myndast við sundurliðun glúkósa og fitusýra). Í frásogandi ástandi örvar glúkagon í gegnum próteningenasa A fosfórýleringu HMG - CoA - redúktasa og breytir því í óvirkt ástand. Þessi aðgerð er aukin með því að á sama tíma örvar glúkagon fosfórýleringu og óvirkjun fosfótasa af HMG-CoA redúktasa og heldur þannig HMG-CoA redúktasa í fosfórýleruðu óvirku ástandi. Fyrir vikið er myndun kólesteróls á eftir frásogstímabilinu og meðan á föstu stendur, hamlað með innrænni myndun. Ef kólesterólinnihaldið í matnum var komið í 2% lækkaði myndun innræns kólesteróls verulega. En fullkomin stöðvun kólesterólmyndunar á sér ekki stað. Hömlun gráðu á nýmyndun kólesteróls undir áhrifum kólesteróls sem kemur frá mat er mismunandi frá manni til manns. Þetta bendir til þess að aðferðin við kólesterólmyndun er einstaklingsbundin. Með því að draga úr styrk kólesterólmyndunar er mögulegt að draga úr styrk þess í blóði. Ef jafnvægið er milli neyslu kólesteróls með mat og myndun þess í líkamanum annars vegar og útskilnað gallsýra og kólesteróls hins vegar, breytist styrkur kólesteróls í vefjum og blóði. Alvarlegustu afleiðingarnar tengjast aukningu á kólesterólstyrk í blóði (kólesterólhækkun) en líkurnar á að fá æðakölkun og gallsteina aukast. Fjölskyldur kólesterólhækkun (HCS) - þetta form er mun algengara - um það bil 1 sjúklingur á 200 manns. Erfður galli í HCS er brot á frásogi LDL af frumum og því lækkun á tíðni LDL niðurbrots. Fyrir vikið eykst styrkur LDL í blóði, auk kólesteróls þar sem mikið er af því í LDL. Þess vegna, með HCS, er útfelling kólesteróls í vefjum, einkum í húðinni (xanthomas), í veggjum slagæðanna einkennandi. Hömlun á myndun HMG-CoA redúktasa Lokaafurðin á efnaskiptaferli kólesteróls. Það dregur úr umritunarhraða HMG-CoA redúktasa geninu og hamlar þannig eigin myndun. Lifrin nýtir virkan gallsýrur úr kólesteróli og þess vegna hamla gallsýrur virkni HMG-CoA redúktasagensins. Þar sem HMG-CoA redúktasi er til eftir myndun um það bil 3, er hömlun á nýmyndun þessa kólesterólensíma skilvirk áhrif. |