Leiðbeiningar um notkun „Invokany“, samsetning, hliðstæður lyfsins, verð og umsagnir
Sykursýki af tegund 2 hjá fullorðnum ásamt mataræði og hreyfingu til að bæta blóðsykursstjórnun í gæðum:
- Einlyfjameðferð
- Sem hluti af samsettri meðferð með öðrum blóðsykurslækkandi lyfjum, þ.mt insúlíni.
Fyrir fullorðna sykursýki af tegund 2 er ráðlagður skammtur af Invokana 100 mg eða 300 mg einu sinni á dag.
Ef canagliflozin er notað sem viðbót við önnur lyf (auk insúlíns eða lyfja sem auka framleiðslu þess), eru lægri skammtar mögulegir til að draga úr líkum á blóðsykursfalli.
Í sumum tilvikum geta verið miklar líkur á að aukaverkanir á Invocana séu aukaverkanir. Þau geta tengst lækkun rúmmáls í æðum. Þetta getur verið svima, stífla eða réttstöðuþrýstingsfall.
Við erum að tala um svona sjúklinga sem:
- fengið viðbótar þvagræsilyf,
- eiga í erfiðleikum með starfsemi miðlungs nýrna,
- þau eru á elli (eldri en 75 ára).
Í ljósi þessa ættu þessir sjúklingar að neyta kanaglíflózíns í 100 mg skammti einu sinni fyrir morgunmat.
Þeir sjúklingar sem verða fyrir einkennum blóðþurrð verða meðhöndlaðir með hliðsjón af aðlögun á ástandi þeirra áður en meðferð með kanagliflozin hefst.
Sjúklingar sem fá 100 ml af Invokan lyfi og þola það vel og þurfa einnig viðbótarstýringu á blóðsykri, verða færðir í allt að 300 mg skammt af canagliflozin.
Ofskömmtun
Einkenni Engin þekkt tilfelli eru ofskömmtunar af kanaglíflózíni. Stakir skammtar af canagliflozin, sem náðu 1600 mg hjá heilbrigðum einstaklingum og 300 mg tvisvar á dag í 12 vikur hjá sjúklingum með sykursýki af tegund 2, þoldust almennt vel.
Meðferð Ef um ofskömmtun Invokan er að ræða er nauðsynlegt að framkvæma venjulega stuðningsúrræði, til dæmis til að fjarlægja efnið sem ekki frásogast úr meltingarveginum, gera klíníska athugun og framkvæma viðhaldsmeðferð með tilliti til klínísks ástands sjúklings. Canagliflozin skilst nánast ekki út við 4 klukkustunda skilun. Ekki er búist við að Canagliflozin skiljist út með kviðskilun.
Frábendingar:
Ekki er hægt að nota lyfið Invokana við slíkar aðstæður:
- ofnæmi fyrir kanaglíflózíni eða öðru efni sem var notað sem hjálpartæki,
- sykursýki af tegund 1
- ketónblóðsýring með sykursýki,
- alvarleg nýrnabilun
- alvarleg lifrarbilun,
- meðganga og brjóstagjöf,
- börn yngri en 18 ára.
Á meðgöngu og meðan á brjóstagjöf stendur hafa rannsóknir á viðbrögðum líkamans við lyfinu Invocana ekki verið gerðar. Í dýratilraunum kom ekki í ljós að kanaglíflózín hefur óbein eða bein eituráhrif á æxlunarkerfið.
Samt sem áður er mjög mælt með notkun lyfsins hjá konum á þessu tímabili ævi sinnar, vegna þess að aðalvirka efnið er hægt að komast í brjóstamjólk og verð slíkrar meðferðar getur verið réttlætanlegt.
Milliverkanir við önnur lyf og áfengi:
Canagliflozin olli ekki tjáningu CYP450 ísóensíma (3A4, 2C9, 2C19, 2B6 og 1A2) í menningu lifrarfrumna úr mönnum. Hann hamlaði heldur ekki ísóensímum af cýtókróm P450 (1A2, 2A6, 2C19, 2D6 eða 2E1) og hamlaði lítillega CYP2B6, CYP2C8, CYP2C9, CYP3A4, samkvæmt rannsóknarrannsóknum þar sem notast var við lifrar-smásjár úr mönnum. In vitro rannsóknir hafa sýnt að kanaglíflózín er hvarfefni umbrotsensíma UGT1A9 og UGT2B4 og lyfjagjafar P-glýkópróteins (P-gp) og MRP2. Canagliflozin er veikur hemill P-gp.
Canagliflozin umbrotnar í lágmarki oxunar. Klínískt marktæk áhrif annarra lyfja á lyfjahvörf kanaglíflózíns í gegnum cýtókróm P450 kerfið eru því ólíkleg.
Samsetning og eiginleikar:
Í 1 töflu af Invocan, filmuhúðað 100 mg, inniheldur:
Virkt efni: 102,0 mg af canagliflozin hemihydrat, sem jafngildir 100,0 mg af canagliflozin. Hjálparefni (kjarni): örkristallaður sellulósi 39,26 mg, vatnsfrír laktósi 39,26 mg, kroskarmellósnatríum 12,00 mg, hýprólósi 6,00 mg, magnesíumsterat 1,48 mg. Hjálparefni (skel): Opadry II litarefni 85F92209 gult (að hluta til samsett úr pólývínýlalkóhóli, vatnsrofið að hluta, 40,00%, títantvíoxíð 24,25%, makrógól 3350 20,20%, talkúm 14,80%, gult járnoxíð ( E172) 0,75%) - 8,00 mg.
Í 1 töflu af Invocan, filmuhúðuð 300 mg, inniheldur:
306,0 mg af kanaglíflózín hemihýdrati, sem jafngildir 300,0 mg af kanaglíflózíni. Hjálparefni (kjarni): örkristallaður sellulósi 117,78 mg, vatnsfrír laktósi 117,78 mg, kroskarmellósnatríum 36,00 mg, hýprólósi 18,00 mg, magnesíumsterat 4,44 mg. Hjálparefni (skel): Opadray II 85F18422 hvítt litarefni (pólývínýlalkóhól, vatnsrofið að hluta, 40,00% títantvíoxíð 25,00%, makrógól 3350 20,20%, talkúm 14,80%) - 18,00 mg .
Filmuhúðaðar töflur.
Invokana lyf er nauðsynlegt til meðferðar á sykursýki af tegund 2 hjá fullorðnum. Meðferð felur í sér sambland við strangt mataræði, sem og reglulega hreyfingu.
Blóðsykursfall verður verulega bætt þökk sé einlyfjameðferð, sem og samhliða meðferð með öðrum blóðsykurslækkandi lyfjum.
Slepptu formi
Lyfinu er dreift í formi töflna húðuð með gulu eða hvítu filmuhúð. Hylkislaga pillur eru mismunandi eftir skömmtum.
Ef varan inniheldur 100 mg af virka efninu er taflan gul. Á annarri hliðinni er áletrunin „CFZ“, á hinni er skömmtum ávísað. Ef lyfið inniheldur 300 mg af canagliflozin eru hylkin lituð hvít. Leturgröftur fer fram samkvæmt sömu meginreglum.

Lyfhrif og lyfjahvörf
Virka efnið er hemill á Na-háðri glúkósa flutningsaðila. Vegna þessa eiginleika minnkar endurupptöku hreinsaðs sykurs og nýrnaþröskuldur fyrir sykur minnkar. Fyrir vikið eykst útskilnaður kolvetna í þvagi. Þegar rannsóknin var tekin 300 mg af lyfinu fyrir máltíðir hjá sjúklingum með sykursýki af tegund 2 varð hægur á frásogi sykurs í þörmum og minnkaði glúkósa vegna nýrna- og utanaðkomandi aðgerða.
Mikilvægt! Árangur lyfsins fer ekki eftir fæðuinntöku.
Lyfið einkennist af virkri frásogi. 60 mínútum eftir gjöf er hámarksstyrkur virka efnisþáttarins sést. Tíminn sem það tekur að fjarlægja helming efnisins tekur u.þ.b. 10,5 klukkustundir ef þú tekur 100 mg af Invokana og 13 klukkustundir ef þú tekur 300 mg. Aðgengi lyfsins er 65%. Einnig sést virk binding við prótein - 99%.
Vísbendingar og frábendingar
Bein ábending fyrir notkun lyfsins er insúlínháð sykursýki. Notkun er möguleg í formi einlyfjameðferðar ásamt líkamsrækt og sérstöku mataræði. Einnig er lyfinu ávísað í samsettri meðferð með öðrum sykursýkislyfjum.
Frábendingar til að nota fela í sér óþol fyrir íhlutum lyfsins. Ekki er heldur mælt með því að nota lyfið við nýrna- og lifrarbilun, alvarlegum langvinnum hjartasjúkdómum. Börn og unglingar, sykursýki af tegund 1, meðganga og brjóstagjöf eru einnig ástæður þess að neita þessu lyfi.

Aukaverkanir
Aukaverkanir koma tiltölulega sjaldan fram - 2% tilvika. Algengustu aukaverkanirnar má kalla polyuria - aukning á magni þvags sem skilst út. Einnig getur sjúklingurinn kvartað undan ógleði, miklum þorsta, hægðatregðu.

Sjaldgæfari eru bólgusjúkdómar í kynfærum. Balanitis, vulvovaginitis, balanoposthitis, blöðrubólga koma venjulega fram. Útbrot á húð, lágþrýstingur, kemur sjaldan fram.
Skammtar og ofskömmtun
Mælt er með meðferð með því að byrja með 100 mg skammti á dag. Ef sjúklingurinn fer í meðferð án aukaverkana en fullkominn stjórn á blóðsykursstyrk næst ekki, er hægt að auka skammtinn í 300 mg á dag. Ef Invokana er notað sem hluti af samsettri meðferð er skammtaaðlögun samhliða lyfja nauðsynleg.
Ofskömmtun kemur mjög sjaldan fyrir. Sjúklingar með sykursýki af tegund 2 þola 600 mg á dag. Ef versnun á ástandi sjúklingsins meðan á lyfjameðferðinni stóð enn gerðist, þá er þörf á magaskolun og notkun sorbents.
Samspil
Þegar það er notað með þvagræsilyfjum er aukning á áhrifum þeirra vart. Þetta kemur fram með aukningu á þvagræsingu, sem getur valdið ofþornun. Notkun lyfja ásamt öðrum blóðsykurslækkandi lyfjum eykur hættuna á of mikilli lækkun á blóðsykri.
Athygli! Til að koma í veg fyrir blóðsykursfall er mælt með stöðugu eftirliti með glúkósa og skammtaaðlögun.
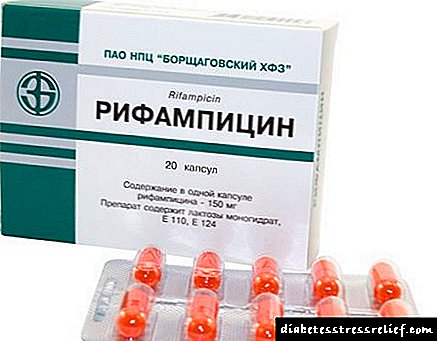
Invokana hefur samskipti við ensímhvata (barbitúröt, Rifampicin, Phenytoin, Carbamazepin, Ritonavir). Þetta kemur fram með lækkun á blóðsykurslækkandi áhrifum.
Breytingar á lyfjahvörfum hafa ekki sést í tengslum við getnaðarvarnarlyf til inntöku, Metformin. Þess vegna er hægt að sameina þessa sjóði.
Það er aðeins ein lyfja hliðstæða þróuð í virka efninu - Vokanamet. Í samanburðarlýsingunni er litið á staðgengla fyrir lyfjafræðilega verkun.
| Lyfjaheiti | Virkur hluti | Hámarksmeðferð (klukkustundir) | Framleiðandi |
| Vokanamet | Canagliflozin, metformin | 24 | Janssen Ortho LLS / Janssen-Silag S.p.A. fyrir „Johnson & Johnson, LLC“, Bandaríkjunum / Ítalíu / Rússlandi |
| Victoza | liraglutide | 24 | Novo Nordisk, A / T, Danmörku |
| Jardins | empagliflozin | 24 | Beringer Ingelheim Pharma GmbH & Co. KG, Þýskalandi |
Þessi lyf eru ekki síður áhrifarík. En óháð vali á lyfjum er ekki mælt með því.
Skoðanir sjúklinga sem notuðu lyfið.
Lyfið „Invokana“ var ráðlagt af innkirtlafræðingi. Verðið er hátt, en áhrifin eru áberandi. Blóðsykur við efri mörk eðlilegra og hækkar ekki, sem er mjög gott!
Konstantin, 47 ára
Fyrir nokkrum árum greindist ég með sykursýki af tegund 2. Hann var meðhöndlaður af Metformin en hjálpaði ekki. Þá ávísaði læknirinn Invocana. Sykurmagnið hefur stöðugt og mér líður miklu betur.
Ég er með sykursýki í langan tíma. Ég prófaði mörg lyf, sum hjálpuðu alls ekki. Nýlega mælti læknirinn með lyfinu „Invokana“. Í fyrstu hræddi verðið við mig, en ákvað að kaupa það. Niðurstaðan var ekki löng að koma. Sykur eykst nánast ekki, honum líður vel.
Valeria, 63 ára
Kostnaður við lyfið í rúblur í sumum borgum Rússlands:
| Borg | Invokana 100 mg N30
| Invokana 300 mg N30 |
| Moskvu | 2653 | 4444 |
| Chelyabinsk | 2537,90 | 4226,10 |
| Sankti Pétursborg | 3010 | 4699 |
| Úlyanovsk | 2511,70 | 4211,10 |
| Tomsk | 2477 | 4185 |
| Saratov | 2531 | 4278 |
Verð lyfsins er hátt. Þetta fyrir marga sjúklinga verður ástæðan fyrir því að hafna meðferð með lyfinu.
Niðurstaða
Þrátt fyrir þá staðreynd að Invokana er dýrt lyf er það árangur meðal sykursjúkra. Skilvirkni og lítill fjöldi aukaverkana eru mikilvægir kostir lyfsins.
Sykursýki þarf rétta meðferð. Flókið lyfjameðferð, næring og hreyfing hefur góðan blóðsykurslækkandi áhrif. Regluleg lyf og samræmi við allar ávísanir innkirtlafræðings er lykillinn að árangri allra sjúklinga. Þú getur fundið frekari upplýsingar úr þessu myndbandi:
Skammtaform:
Í 300 mg filmuhúðuðri töflu inniheldur:
306,0 mg af kanaglíflózín hemihýdrati, sem jafngildir 300,0 mg af kanaglíflózíni.
Hjálparefni (kjarna): örkristallaður sellulósi 117,78 mg, vatnsfrír laktósi 117,78 mg, kroskarmellósnatríum 36,00 mg, hýprólósi 18,00 mg, magnesíumsterat 4,44 mg.
Hjálparefni (skel): Opadray II 85F18422 hvítt litarefni (pólývínýlalkóhól, vatnsrofið að hluta, 40,00% títantvíoxíð 25,00%, makrógól 3350 20,20%, talk 14,80%) - 18,00 mg.
Lýsing:
Skammtar 100 mg: hylkislaga töflur *, húðaðar með gulri filmuhúð, greypt á annarri hliðinni með CFZ og á hinni með 100.
* Á þversnið er taflkjarninn hvítur eða næstum hvítur.
Skammtar 300 mg: hylkislaga töflur húðaðar með filmuhimnu af hvítum eða næstum hvítum lit, greyptar á annarri hliðinni með CFZ og á hinni 300.
Lyfjafræðilegir eiginleikar:
Lyfhrif
Í klínískum rannsóknum, eftir stakan og endurtekna inntöku kanaglíflózíns hjá sjúklingum með sykursýki af tegund 2, var nýrnaþröskuldur glúkósa minnkaður skammtaháð og útskilnaður glúkósa í nýrum. Upphafsgildi nýrnaþröskuldar fyrir glúkósa var um 13 mmól / L, hámarkslækkun 24 klukkustunda meðaltals nýrnaþröskuldar glúkósa sást við notkun canagliflozin í 300 mg skammti einu sinni á dag og var á bilinu 4 til 5 mmól / L, sem bendir til lítillar hættu á að koma fyrir blóðsykurslækkun meðan á meðferð stendur. Í I. stigs rannsóknum á sjúklingum með sykursýki af tegund 2 sem fengu kanaglíflózín í skammtinum 100 mg eða 300 mg leiddi lækkun á nýrnaþröskuld glúkósa til aukningar á útskilnaði glúkósa í nýrum um 77-119 g / dag, og útsetning glúkósa hjá nýjum samsvaraði tapi frá 308 til 476 kkal / dag. Lækkun nýrnaþröskuldar glúkósa og aukning á útskilnaði glúkósa um nýru varaðist á 26 vikna meðferðartímabili hjá sjúklingum með sykursýki af tegund 2. Það var meðalhækkun á magni þvags daglega (sog
Meðal heildaraðgengi kanaglíflózíns er um það bil 65%. Að borða mat sem er fituríkur hafði ekki áhrif á lyfjahvörf canagliflosins, svo hægt er að taka canagliflosin með eða án matar. Með hliðsjón af getu canagliflozin til að draga úr aukningu á blóðsykursfalli eftir fæðingu vegna hægari frásogs glúkósa í þörmum er mælt með því að taka canagliflozin fyrir fyrstu máltíðina.
Dreifing
Meðal dreifingarrúmmál kanaglíflózíns í jafnvægi eftir staka innrennsli í bláæð hjá heilbrigðum einstaklingum var 83,5 l, sem bendir til víðtækrar dreifingar í vefjum. Canagliflosin tengist að mestu leyti plasmapróteinum (99%), aðallega albúmíni. Samskipti við prótein eru ekki háð styrk canagliflozin í plasma. Samskipti við plasmaprótein breytast ekki marktækt hjá sjúklingum með skerta nýrna- eða lifrarstarfsemi.
Umbrot
O-glúkúróníðmyndun er aðalvegur fyrir umbrot kanaglíflózíns. Glúkúróníðmyndun kemur aðallega fram með þátttöku UGT1A9 og UGT2B4 af allt að tveimur óvirkum O-glúkúróníð umbrotsefnum. Aukning á AUC fyrir canagliflozin (um 26% og 18%) sást hjá sjúklingum sem voru með UGT1A9 * 3 og UGT2B4 * 2 samsæturnar. Ekki er búist við að þessi áhrif hafi klíníska þýðingu. CYP3A4-miðluð (oxunar) umbrot canagliflozin í mannslíkamanum er í lágmarki (u.þ.b. 7%).
Ræktun
Eftir að hafa tekið einn stakan skammt af 14C-canagliflozin af heilbrigðum sjálfboðaliðum til inntöku, greindust 41,5%, 7,0% og 3,2% af gefnum geislavirka skammti í saur sem kanagliflosin, hýdroxýlerað umbrotsefni og O-glúkúróníð umbrotsefni.Dreifing í meltingarvegi kanaglíflózíns var hverfandi.
Um það bil 33% af gefnum geislavirka skammti fundust í þvagi, aðallega sem O-glúkúróníð umbrotsefni (30,5%). Minna en 1% af skammtinum skilst út sem óbreyttur kanaglíflózín í nýrum. Nýrnaúthreinsun með notkun kanagliflozins í skömmtum 100 mg og 300 mg var á bilinu 1,30 til 1,55 ml / mín.
Kanagliflozin vísar til lyfja með litla úthreinsun, meðaltal almenn úthreinsun er um það bil 192 ml / mín. Hjá heilbrigðum einstaklingum eftir gjöf í bláæð.
Sérstakir sjúklingahópar
Sjúklingar með skerta nýrnastarfsemi
Cmax fyrir canagliflozin jókst í meðallagi um 13%, 29% og 29% hjá sjúklingum með skerta nýrnastarfsemi, í meðallagi alvarleg og alvarleg, en þó ekki hjá sjúklingum í blóðskilun. Í samanburði við heilbrigða sjálfboðaliða jókst AUC fyrir kanaglíflózíni í sermi um 17%, 63% og 50% hjá sjúklingum með vægt, miðlungs og alvarlega nýrnabilun, í sömu röð, en var það sama hjá heilbrigðum sjálfboðaliðum og sjúklingum með langvarandi nýrnabilun á lokastigi (CRF) )
Afturköllun kanaglíflózíns með skilun var í lágmarki.
Sjúklingar með skerta lifrarstarfsemi
Eftir notkun canagliflozin í 300 mg skammti einu sinni samanborið við sjúklinga með eðlilega lifrarstarfsemi hjá sjúklingum með skerta lifrarstarfsemi í samræmi við Child-Pugh kvarðann (skert væg lifrarstarfsemi) jókst Cmax og AUC AU um 7% og 10%, hvort um sig og fækkaði um 4% og jókst um 11%, í sömu röð, hjá sjúklingum með skerta lifrarstarfsemi í gráðu B samkvæmt Child-Pugh kvarða (skert lifrarstarfsemi með miðlungs alvarleika). Ekki er talið að þessi munur sé klínískt marktækur. Ekki er þörf á skammtaaðlögun hjá sjúklingum með væga eða miðlungsmikla lifrarbilun. Engin klínísk reynsla er af notkun lyfsins hjá sjúklingum með verulega skerta lifrarstarfsemi (flokkur C á Child-Pugh kvarða), því má ekki nota notkun kanagliflozins hjá þessum sjúklingahópi.
Aldraðir sjúklingar (≥65 ára)
Samkvæmt niðurstöðum þýðisgreiningar á lyfjahvörfum hafði aldur ekki klínískt marktæk áhrif á lyfjahvörf kanaglíflózíns.
Börn (
Rannsóknir á lyfjahvörfum kanagliflozins hjá börnum hafa ekki verið gerðar.
Aðrir sjúklingahópar
Ekki er þörf á aðlögun skammta miðað við kyn, kynþátt / þjóðerni eða líkamsþyngdarstuðul. Þessir eiginleikar höfðu ekki klínískt marktæk áhrif á lyfjahvörf kanaglíflózíns, samkvæmt niðurstöðum greiningar á lyfjahvörfum.
Frábendingar
- Ofnæmi fyrir kanaglíflózíni eða einhverju hjálparefnis,
- sykursýki af tegund 1
- ketónblóðsýring með sykursýki,
- nýrnabilun með gauklasíunarhraða (GFR) 2,
- alvarleg lifrarbilun
- laktósaóþol, laktasaskortur, vanfrásog glúkósa-galaktósa,
- langvarandi hjartabilun III - IV starfshópur (flokkun NYHA),
- meðgöngu og brjóstagjöf, börn yngri en 18 ára.
Með sögu um ketónblóðsýringu með sykursýki
Notist á meðgöngu og meðan á brjóstagjöf stendur
Brjóstagjöf
Ekki má nota konaglíflózín handa konum meðan á brjóstagjöf stendur. Samkvæmt fyrirliggjandi lyfjafræðilegum / eiturefnafræðilegum gögnum úr dýrarannsóknum berst canagliflozin í brjóstamjólk. Ekki er vitað hvort kanaglíflózín berst í brjóstamjólk.
Skammtar og lyfjagjöf
Skammta sleppa
Ef gleymist að taka skammt, á að taka hann eins fljótt og auðið er, þó á ekki að taka tvöfaldan skammt innan eins dags.
Sérstakir flokkar sjúklinga
Börn yngri en 18 ára
Öryggi og verkun canagliflozin hjá börnum hefur ekki verið rannsakað.
Aldraðir sjúklingar
Gefa skal sjúklingum> 75 ára að aldri 100 mg einu sinni á dag sem upphafsskammtur. Íhuga ætti nýrnastarfsemi og hættu á blóðþurrð í blóði.
Skert nýrnastarfsemi
Hjá sjúklingum með vægt skerta nýrnastarfsemi (áætlaður gauklasíunarhraði (GFR) frá 60 til 90 ml / mín. / 1,73 m 2) er ekki þörf á aðlögun skammta.
Hjá sjúklingum með skerta nýrnastarfsemi með GFR frá 45 til 60 ml / mín. / 1,73 m 2 er mælt með notkun lyfsins í 100 mg skammti einu sinni á dag.
Ekki er mælt með notkun Kanagliflozin handa sjúklingum með skerta nýrnastarfsemi með GFR 2, langvarandi nýrnabilun á lokastigi eða sjúklingum sem eru í skilun, þar sem búist er við að canagliflozin verði árangurslaust hjá þessum sjúklingahópum.
Aukaverkanir
Aukaverkanir sem tengjast minnkun rúmmáls í æðum
Tíðni allra aukaverkana í tengslum við minnkun rúmmáls í æðum (sundl, stíflun, réttstöðuþrýstingur, slagæðarþrýstingur, ofþornun og yfirlið) var 1,2% þegar notkun canagliflozin var notuð í 100 mg skammti, 1,3% þegar notaður var canagliflosin í 300 mg skammti og 1,1% með lyfleysu. Tíðni aukaverkana í tengslum við minnkun rúmmáls í æðum við notkun lyfsins Invokana var svipuð og þegar samanburðarlyf voru notuð í tveimur virkum samanburðarrannsóknum.
Í rannsókn á áhættu á hjarta- og æðakerfi, sem tóku þátt í að meðaltali eldri sjúklingum og með hærri tíðni samtímis sjúkdóma, var tíðni aukaverkana í tengslum við lækkun rúmmáls í æð 2,8% þegar þeir notuðu kanagliflozin í 100 mg skammti, 4 , 6% þegar þú notar canagliflozin í 300 mg skammti og 1,9% þegar lyfleysa er notað.
Samkvæmt niðurstöðum almennrar greiningar höfðu sjúklingar sem fengu „lykkju“ þvagræsilyf, sjúklingar með miðlungs nýrnabilun (GFR frá 30 til 60 ml / mín. / 1,73 m 2) og sjúklingar á aldrinum> 75 ára hærri tíðni þessara óæskilegu. viðbrögð. Hjá sjúklingum sem fengu þvagræsilyf „lykkju“ var tíðnin 3,2% þegar þeir notuðu canagliflozin í 100 mg skammti, 8,8% í 300 mg skammti og 4,7% í samanburðarhópnum. Hjá sjúklingum með GFR 2 í upphafi var tíðnin 4,8% þegar þeir notuðu canagliflozin í 100 mg skammti, 8,1% í 300 mg skammti og 2,6% í samanburðarhópnum. Hjá sjúklingum 75 ára og eldri var tíðnin 4,9% þegar þeir notuðu canagliflozin í 100 mg skammti, 8,7% í 300 mg skammti og 2,6% í samanburðarhópnum.
Þegar rannsókn var gerð á áhættu á hjarta og æðakerfi jókst tíðni afturköllunar lyfja vegna aukaverkana í tengslum við minnkun rúmmáls í æðum og tíðni svo alvarlegra aukaverkana við notkun canagliflozin jókst ekki.
Blóðsykurslækkun þegar það er notað sem viðbót við insúlínmeðferð eða lyf sem auka seytingu þess
Tíðni blóðsykurslækkunar var lítil (100 mg, 300 mg og lyfleysa, í sömu röð); alvarleg blóðsykursfall kom fram hjá 1,8%, 2,7% og 2,5% sjúklinga sem fengu Invocana ® í 100 mg, 300 mg skammti og Þegar lyfleysu var notað sem viðbót við sulfonylurea afleiður, sást blóðsykurslækkun hjá 4,1%, 12,5% og 5,8% sjúklinga sem fengu Invocana ® í 100 mg, 300 mg skammti og lyfleysu.
Sveppasýking í kynfærum
Kandidiasis vulvovaginitis (þ.mt bólgusjúkdómabólga og sveppasýking í brjóstholi) sást hjá 10,4%, 11,4% og 3,2% kvenna sem fengu Invocana ® í 100 mg skammti, 300 mg og lyfleysu. Flestar tilkynningarnar um candidasjúkdóm í legslímu í tengslum við fyrstu fjóra mánuðina eftir að meðferð með kanagliflozin hófst. Meðal sjúklinga sem fengu meðferð með kanaglíflózíni, höfðu 2,3% fleiri en einn þátt í sýkingu. 0,7% allra sjúklinga hættu töku kanaglíflózíns vegna bjúgsvefbólgu.
Candidiasis balanitis eða balanoposthitis kom fram hjá 4,2%, 3,7% og 0,6% karla sem fengu lyfið Invokana ® í 100 mg skammti, 300 mg og lyfleysu. Meðal sjúklinga sem fengu meðferð með kanaglíflózíni, höfðu 0,9% fleiri en einn sýkingu. 0,5% allra sjúklinga hættu að taka canagliflozin vegna candida balanitis eða balanoposthitis. Tilkynnt var um blóðvef hjá 0,3% karla sem ekki gengust undir umskurð. Í 0,2% tilvika voru sjúklingar sem fengu canagliflozin umskornir.
Þvagfærasýkingar
Þvagfærasýking kom fram hjá 5,9%, 4,3% og 4,0% sjúklinga sem fengu lyfið Invokana ® í 100 mg skammti, 300 mg og lyfleysu. Flestar sýkingar voru vægar eða í meðallagi alvarlegar; tíðni alvarlegra aukaverkana jókst ekki. Sjúklingar svöruðu venjulegri meðferð og héldu áfram meðferð með kanaglíflózíni. Tíðni endurtekinna sýkinga jókst ekki með notkun canagliflozin.
Beinbrot
Í rannsókn á árangri hjarta- og æðakerfis hjá 4.327 sjúklingum með greindan hjarta- og æðasjúkdóm eða mikla hjarta- og æðaráhættu, var tíðni beinbrota 16,3, 16,4 og 10,8 á hver 1000 sjúklingaár í 100 mg skammta af Invocana ®. og 300 mg og lyfleysa, í sömu röð. Ójafnvægi á tíðni beinbrota kom fram á fyrstu 26 vikum meðferðar.
Í samanlagðri greiningu á öðrum rannsóknum á lyfinu Invokana ®, sem tóku til um 5800 sjúklinga með sykursýki af tegund 2 frá almenningi, var enginn munur á hættu á beinbrotum með tilliti til eftirlits.
Eftir 104 vikna meðferð hafði canagliflozin ekki neikvæð áhrif á beinþéttni.
Rannsóknarstofubreytingar
Aukin kalíumþéttni í sermi
Meðalbreyting á styrk kalíums í sermi frá upphafsgildinu var 0,5%, 1,0% og 0,6% þegar lyfið Invokana var notað í 100 mg skammta, 300 mg og lyfleysu. Tilfelli af auknum styrk kalíums í sermi (> 5,4 mEq / l og 15% hærri en upphafsstyrkur) sáust hjá 4,4% sjúklinga sem fengu kanagliflozin í 100 mg skammti, hjá 7,0% sjúklinga sem fengu canagliflozin í 300 mg skammti og 4,8% sjúklinga sem fengu lyfleysu. Almennt var aukning á kalíumþéttni lítil (® í skömmtum 100 mg, 300 mg og lyfleysa, hvort um sig.) Meðalbreyting á styrk þvagefnis köfnunarefnis frá upphafsgildinu var 17,1%, 18,0% og 2,7% þegar lyfið Invokana var notað 100 mg, 300 mg skammtar og lyfleysa, hver um sig. Þessar breytingar komu venjulega fram innan 6 vikna frá upphafi meðferðar. Í kjölfarið minnkaði styrkur kreatíníns smám saman í upphaflegt gildi og styrkur þvagefni köfnunarefnis hélst stöðugur.
Hlutfall sjúklinga með marktækari lækkun GFR (> 30%) samanborið við upphafsstigið sem sást á hverju stigi meðferðar var 2,0% þegar þeir notuðu kanagliflozin í 100 mg skammti, 4,1% þegar lyfið var notað í 300 mg skammti og 2 , 1% með lyfleysu. Þessi lækkun GFR var oft tímabundin og í lok rannsóknarinnar kom fram svipuð lækkun á GFR hjá færri sjúklingum: 0,7% þegar þeir notuðu canagliflozin í 100 mg skammti, 1,4% þegar lyfið var notað í 300 mg skammti og 0,5% við lyfleysu umsókn.
Eftir að canagliflozin var stöðvað gengust þessar breytingar á rannsóknarstofuþáttum jákvæðri virkni eða fóru aftur í upphaflegt stig.
Breyting á styrk kólesteróls
Meðalbreyting á LDL frá upphafsstyrk samanborið við lyfleysu var 0,11 mmól / l (4,5%) og 0,21 mmól / l (8,0%) þegar notkun kanagliflozins var gefin í 100 mg skömmtum og 300 mg. Minni aukning varð á styrk heildar kólesteróls frá upphafsgildi samanborið við lyfleysu - 2,5% og 4,3% þegar notkun kanagliflozins var gefin í 100 mg skömmtum og 300 mg. Aukning HDL frá upphafsstyrk samanborið við lyfleysu var 5,4% og 6,3% þegar notkun kanagliflozins var gefin í 100 mg og 300 mg skömmtum. Aukning á styrk kólesteróls sem ekki tengdist HDL frá upphafsgildi samanborið við lyfleysu var 0,05 mmól / l (1,5%) og 0,13 mmól / l (3,6%) þegar notkun kanaglíflózíns var notuð í 100 mg skömmtum og 300 mg, hvort um sig. Hlutfall LDL / HDL breyttist ekki við notkun lyfsins Invokana ® samanborið við lyfleysu. Styrkur apolipoprotein B, fjöldi LDL agna og styrkur kólesteróls sem ekki er tengdur HDL jókst í minna mæli samanborið við breytingar á LDL styrk.
Aukinn styrkur blóðrauða
Meðalbreytingar á blóðrauðaþéttni frá upphafsgildinu voru 4,7 g / l (3,5%), 5,1 g / l (3,8%) og 1,8 g / l (-1,1%) þegar þeim var beitt canagliflozin í skömmtum 100 mg, 300 mg og lyfleysu, í sömu röð. Sambærileg lítilsháttar aukning á meðalprósentubreytingu á fjölda rauðra blóðkorna og blóðrauða frá grunnlínu kom fram. Í lok meðferðar höfðu 4,0%, 2,7% og 0,8% sjúklinga sem fengu meðferð með Invocana ® í 100 mg, 300 mg skömmtum og lyfleysu, blóðrauðaþéttni hærri en eðlileg efri mörk.
Aukinn þéttni fosfats í sermi
Við notkun lyfsins Invokana ® sást skammtaháð aukning á þéttni fosfats í sermi. Í 4 klínískum rannsóknum voru meðalbreytingar á styrk fosfats í sermi 3,6%, 5,1% og 1,5% þegar notkun kanagliflozins var gefin í 100 mg, 300 mg skammti og lyfleysu. Tilfellum þar sem aukinn þéttni fosfat var í sermi, meira en 25% af upphafsgildinu, sáust hjá 0,6%, 1,6% og 1,3% sjúklinga sem fengu meðferð með Invocana ® í skömmtum 100 mg, 300 mg og lyfleysu, í sömu röð.
Lækkað þéttni þvagsýru í sermi
Með notkun kanagliflozins í 100 mg og 300 mg skömmtum kom fram hófleg lækkun á meðalstyrk þvagsýru frá upphafsstiginu (−10,1% og −10,6%, í sömu röð) samanborið við lyfleysu, með notkun þess sem lítilsháttar aukning varð á meðalstyrknum frá upphafi (1,9%). Lækkun þéttni þvagsýru í sermi hjá kanaglíflózínhópunum var hámarks eða nálægt hámarki í viku 6 og hélst meðan á meðferð stóð. Tímabundin aukning á þéttni þvagsýru í þvagi kom fram. Samkvæmt niðurstöðum samsettrar greiningar á notkun kanaglíflózíns í 100 mg og 300 mg skömmtum var sýnt að tíðni nýrnabólga var ekki aukin.
Öryggi hjarta- og æðasjúkdóma
Engin aukning varð á áhættu á hjarta og æðakerfi með kanaglíflózíni samanborið við lyfleysuhópinn.
Aukaverkanir hjá sérstökum sjúklingahópum
Aldraðir sjúklingar
Öryggissnið hjá öldruðum sjúklingum er almennt í samræmi við það hjá ungum sjúklingum. Sjúklingar eldri en 75 ára voru með hærri tíðni aukaverkana í tengslum við lækkun rúmmáls í æðum (sundl, stelling, réttstöðuþrýstingsfall, slagæðaþrýstingsfall) - 4,9%, 8,7% og 2,6% þegar lyfið Invokana var notað í skömmtum 100 mg, 300 mg og lyfleysa, hvort um sig. Það minnkaði GFR um 3,6%, 5,2% og 3,0% þegar lyfið Invokana var notað í 100 mg, 300 mg skammta og lyfleysu.
Sjúklingar með GFR frá 45 til 60 ml / mín. / 1,73 m 2
Hjá sjúklingum með upphaflegt GFR gildi 45-60 ml / mín. / 1,73 m 2 var tíðni aukaverkana sem tengdust lækkun rúmmáls í æð 4,6%, 7,1% og 3,4% þegar lyfið Invokana var notað í skömmtum 100 mg, 300 mg og lyfleysa, hvort um sig. Styrkur kreatíníns í sermi jókst um 4,9%, 7,3% og 0,2% þegar lyfið Invokana var notað í 100 mg, 300 mg skammta og lyfleysu. Köfnunarefnisstyrkur þvagefnis í sermi jókst um 13,2%, 13,6% og 0,7% þegar lyfið Invokana var notað í 100 mg, 300 mg skammta og lyfleysu. Hlutfall sjúklinga með mikla lækkun GFR (> 30%) á hverjum tíma í meðferð var 6,1%, 10,4% og 4,3% þegar þeir notuðu lyfið Invocana ® í skömmtum 100 mg, 300 mg og lyfleysu, í sömu röð.Í lok rannsóknarinnar var þetta hlutfall 2,3%, 4,3% og 3,5% þegar lyfið Invokana var notað í 100 mg, 300 mg skammta og lyfleysu.
Tíðni aukningar á þéttni kalíums í sermi (> 5,4 mEq / L og 15% af upphafsgildi) var 5,2%, 9,1% og 5,5% þegar lyfið Invokana var notað í 100 mg skammta, 300 mg og lyfleysu. . Mjög sjaldan hefur sést hærri hækkun á þéttni kalíums í sermi hjá sjúklingum með í meðallagi skerta nýrnastarfsemi sem hafa áður haft aukningu á þéttni kalíums í sermi og / eða verið meðhöndluð með nokkrum lyfjum til að draga úr útskilnaði kalíums, svo sem kalíumsparandi þvagræsilyfjum og angíótensínbreytandi ensímhemlum. Almennt var þessi aukning á styrk skammvinn og krafðist ekki sérstakrar meðferðar.
Styrkur fosfats í sermi jókst um 3,3%, 4,2% og 1,1% þegar lyfið Invokana var notað í 100 mg, 300 mg skammta og lyfleysu. Tíðni aukningar á styrk fosfats í sermi (> 1,65 mmól / L og 25% hærri en upphafsgildi) var 1,4%, 1,3% og 0,4% þegar lyfið Invokana var notað í skömmtum 100 mg, 300 mg og lyfleysu , hver um sig. Almennt var þessi aukning á styrk skammvinn og krafðist ekki sérstakrar meðferðar.
Gögn eftir skráningu
Tafla 1 sýnir aukaverkanir sem skráðar voru við athugun eftir skráningu. Aukaverkanir eru kerfisbundnar miðað við hvert líffærakerfið, allt eftir tíðni viðburða með eftirfarandi flokkun: mjög oft (> 1/10), oft (> 1/100,> 1/1000,> 1/10000,
Ofskömmtun
Meðferð
Ef um ofskömmtun er að ræða er nauðsynlegt að framkvæma venjulega stuðningsúrræði, til dæmis að fjarlægja efnið sem ekki frásogast úr meltingarveginum, gera klíníska athugun og framkvæma viðhaldsmeðferð með tilliti til klínísks ástands sjúklings. Canagliflozin skilst nánast ekki út við 4 klukkustunda skilun. Ekki er búist við að Canagliflozin skiljist út með kviðskilun.
Milliverkanir við önnur lyf
In vitro mat á milliverkunum
Umbrot kanaglíflózíns koma aðallega fram með glúkúróníðgjöf um UDF-glúkúrónósýltransferasa UGT1A9 og UGT2B4.
Í rannsóknum in vitro kanaglíflózín hindraði ekki ísóensím af cýtókróm P450 (1A2, 2A6, 2C19, 2D6, 2E1, 2B6, 2C8, 2C9) og örvuðu ekki ísóensím 1A2, 2C19, 2B6, 3A4 .. Canagliflozin hindraði CYP3A svaka in vitroþó í klínískum rannsóknum fundust engar klínískt marktækar milliverkanir. Ekki er búist við að Canagliflozin muni breyta umbrotthreinsun samhliða notuðum lyfjum sem umbrotna er af þessum ísóensímum.
Canagliflozin er hvarfefni P-glýkópróteins (P-gp) og hindrar svaka P-gp-miðlað digoxín flutning.
In vivo samspilsmat
Áhrif annarra lyfja á kanaglíflózín
Cyclosporin, hydrochlorothiazide, getnaðarvarnarlyf til inntöku (levonorgestrel + ethinyl estradiol), metformin og probenecid höfðu ekki klínískt marktæk áhrif á lyfjahvörf canagliflozin.
Rifampicin. Samtímis notkun rifampicins, ósérhæfðs örvunar fjölda ensíma í UGT fjölskyldunni og lyfjafyrirtæki, þar á meðal UGT1A9, UGT2B4, P-gp og MRP2, dró úr útsetningu fyrir canagliflozin, sem getur leitt til minnkunar á virkni þess. Ef nauðsynlegt er að ávísa hvati af UGT fjölskyldumeensímum og lyfjagjöfum (til dæmis rifampicíni, fenýtóín, barbitúrötum, fenóbarbítali, ritonavíri, karbamazepíni, efavírenz, Jóhannesarjurt götuðu) samtímis kanaglíflózíni, er nauðsynlegt að fylgjast með styrk glýkaðs hemóglóbínskammts í 100 einu sinni á dag og kveðið á um möguleika á að auka skammtinn af kanaglíflózíni í 300 mg einu sinni á dag, ef viðbótarstjórnun blóðsykurs er nauðsynleg. Hjá sjúklingum með GFR frá 45 til 60 ml / mín / 1,73 m 2, sem fá lyfið Evokana ® í 100 mg skammti og örvandi lyfið úr UGT fjölskyldu ensíma, og sem þurfa viðbótar blóðsykursstjórnun, skal hafa í huga skipun annarra blóðsykurslækkandi lyfja.
Tafla 2: Áhrif samhliða lyfjagjafar á útsetningu fyrir kanaglíflózíni
| Samtímis lyf | Samhliða skammtur 1 | Skammtur af canagliflozin 1 | Rúmfræðilegt meðalhlutfall (hlutfall vísbendinga við skipun samhliða meðferð / án hennar) Engin áhrif = 1,0 | |
| 2. AUC (90% CI) | Hámark (90% CI) | |||
| Í eftirfarandi tilvikum er ekki þörf á aðlögun skammta af canagliflozin: | ||||
| Siklósporín | 400 mg | 300 mg 1 sinni á dag í 8 daga | 1,23 (1,19–1.27) | 1,01 (0,91–1,11) |
| Levonorgestrel + Etinyl Estradiol | levonorgestrel 0,15 mg ethinyl estradiol 0,03 mg | 200 mg 1 sinni á dag í 6 daga | 0,91 (0,88–0,94) | 0,92 (0,84–0,99) |
| Hýdróklórtíazíð | 25 mg 1 sinni á dag í 35 daga | 300 mg 1 sinni á dag í 7 daga | 1,12 (1,08–1,17) | 1,15 (1,06–1,25) |
| Metformin | 2000 mg | 300 mg 1 sinni á dag í 8 daga | 1,10 (1,05–1,15) | 1,05 (0,96–1,16) |
| Probenecid | 500 mg 2 sinnum á dag í 3 daga | 300 mg 1 sinni á dag í 17 daga | 1,21 (1,16–1,25) | 1,13 (1,00–1,28) |
| Rifampicin | 600 mg 1 sinni á dag í 8 daga | 300 mg | 0,49 (0,44–0,54) | 0,72 (0,61–0,84) |
2. AUCinf fyrir stakskammta lyf og AUC24 - fyrir lyf sem ávísað er í formi margra skammta.
Áhrif kanaglíflózíns á önnur lyf
Í klínískum rannsóknum hjá heilbrigðum sjálfboðaliðum hafði kanaglíflózín ekki marktæk jafnvægisáhrif á lyfjahvörf metformins, getnaðarvarnarlyf til inntöku (levonorgestrel + etinyl estradiol), glibenclamide, simvastatin, paracetamol, hydrochlorothiazide og warfarin.
Digoxín. Notkun samsetningar af canagliflozin (300 mg einu sinni á dag í 7 daga) og digoxin (0,5 mg á fyrsta degi og 0,25 mg næstu 6 daga) leiddi til aukningar á AUC og Cmax af digoxini um 20% og 36 %, hvort um sig, hugsanlega vegna P-gp-miðlaðra milliverkana. Fylgjast skal með sjúklingum sem taka digoxin eða önnur hjartaglýkósíð (t.d. digitoxin).
Tafla 3: Áhrif Canagliflozin á útsetningu fyrir samhliða lyfjum
| Samtímis lyf | Samhliða skammtur 1 | Skammtur af canagliflozin 1 | Rúmfræðilegt meðalhlutfall (hlutfall vísbendinga við skipun samhliða meðferð / án hennar) Engin áhrif = 1,0 | ||
| 2. AUC (90% CI) | Hámark (90% CI) | ||||
| Í eftirfarandi tilvikum er ekki þörf á aðlögun skammta samtímis lyfjum: | |||||
| Digoxín | 0,5 mg 1 sinni á fyrsta degi, þá 0,25 mg í eitt skipti á dag í 6 daga | 300 mg einu sinni á dag innan 7 daga | digoxín | 1,20 (1,12–1,28) | 1,36 (1,21–1,53) |
| Levonorgestrel + Etinyl Estradiol | levonorgestrel 0,15 mg ethinyl estradiol 0,03 mg | 200 mg einu sinni á dag innan 6 daga | levonorgestrel | 1,06 (1,00–1,13) | 1,22 (1,11–1,35) |
| ethinyl estradiol | 1,07 (0,99–1,15) | 1,22 (1,10–1,35) | |||
| Glibenclamide | 1,25 mg | 200 mg einu sinni á dag innan 6 daga | glíbenklamíð | 1,02 (0,98–1,07) | 0,93 (0,85–1,01) |
| Hýdróklórtíazíð | 25 mg einu sinni á dag innan 35 daga | 300 mg einu sinni á dag innan 7 daga | hýdróklórtíazíð | 0,99 (0,95–1,04) | 0,94 (0,87–1,01) |
| Metformin | 2000 mg | 300 mg einu sinni á dag innan 8 daga | metformín | 1,20 (1,08–1,34) | 1,06 (0,93–1,20) |
| Parasetamól | 1000 mg | 300 mg 2 sinnum á dag innan 25 daga | parasetamól | 1,06 3 (0,98–1,14) | 1,00 (0,92–1,09) |
| Simvastatin | 40 mg | 300 mg einu sinni á dag innan 7 daga | simvastatín | 1,12 (0,94–1,33) | 1,09 (0,91–1,31) |
| Warfarin | 30 mg | 300 mg einu sinni á dag innan 12 daga | (R) - warfarin | 1,01 (0,96–1,06) | 1,03 (0,94–1,13) |
| (S) -warfarin | 1,06 (1,00–1,12) | 1,01 (0,90–1,13) | |||
| INR | 1,00 (0,98–1,03) | 1,05 (0,99–1,12) | |||
2. AUCinf fyrir stakskammta efnablöndur og AUC24h - fyrir lyf sem ávísað er sem mörgum skömmtum
3. AUC0-12h
Áhrif á niðurstöður rannsóknarstofu
Greining á 1,5-AG
Aukin útskilnaður glúkósa í nýrum undir áhrifum kanaglíflózíns getur leitt til rangrar lækkunar á styrk 1,5-anhýdróglúkítóls (1,5-AG) og gera afköst þess vafasama. Þess vegna ætti ekki að nota styrk 1,5-AG til að meta blóðsykursstjórnun hjá sjúklingum sem fá Invocana ®. Fyrir frekari upplýsingar er mælt með því að þú hafir samband við 1.5-AG prófunarframleiðandann.
Greining á glúkósa í þvagi
Í ljósi verkunarháttar kanaglíflózíns verður árangur glúkósaprófs í þvagi hjá sjúklingum sem fá lyfið Invokana ®.
Sérstakar leiðbeiningar
Ketoacidosis sykursýki (DKA)
Sjúklingar með sögu um ketónblóðsýringu með sykursýki voru útilokaðir frá klínískum rannsóknum. Ráðlagt er að nota lyfið Invokana ® hjá sjúklingum með sögu um DKA. Hjá mörgum sjúklingum fundust aðstæður sem juku hættuna á DKA (til dæmis sýkingu, stöðvun insúlínmeðferðar).
Sykursýki af tegund 1
Sjúklingar með sykursýki af tegund 1 sem eru að taka lyfið Invokana ®, sem er aukin hætta á DKA. Í 18 vikna klínískri rannsókn kom DKA fram í 5,1% (6/117), 9,4% (11/117) og 0,0% (0/117) sjúklinga sem notuðu lyfið Invokana ® í 100 mg skömmtum, 300 mg og lyfleysa, í sömu röð. Í tengslum við tíðni DKA var þörf á sjúkrahúsvist 12 sjúklinga, í 5 þeirra var styrkur glúkósa í blóði undir 13,9 mmól / L.
Sykursýki af tegund 2
Þegar lyfið Invokana er notað hjá sjúklingum með sykursýki af tegund 2, er greint frá tilvikum um DKA. Samkvæmt klínískum rannsóknum er greint frá þróun alvarlegra aukaverkana, svo sem ketónblóðsýringu með sykursýki, ketónblóðsýringu, efnaskiptablóðsýringu hjá 0,09% (10/10687) sjúklinga sem fengu meðferð með Invocana ®, allir sjúklingar voru fluttir á sjúkrahús. Tilfelli af ketónblóðsýringu með sykursýki sem komu fram hjá sjúklingum með blóðsykursstyrk undir 13,9 mmól / l, voru einnig skráð við athugun eftir skráningu.
Þess vegna ætti að gera ráð fyrir greiningu á DKA hjá sjúklingum með sykursýki af tegund 2, jafnvel þótt styrkur blóðsykurs sé undir 13,9 mmól / L. Til að koma í veg fyrir seint greiningu og tryggja rétta stjórnun sjúklinga, ætti að prófa sjúklinga sem fá lyfið Invokana ® með tilliti til ketóna ef einkenni um efnaskiptablóðsýringu, svo sem mæði, ógleði, uppköst, kviðverkir, rugl, ávaxtaríkt slæmur andardráttur, óvenjuleg þreyta og syfja.
Hjá sjúklingum með sykursýki af tegund 2 með DKA, ættir þú tafarlaust að hætta að nota lyfið Invokana. Íhuga ætti að hætta meðferð með Invocana ® hjá sjúklingum með sykursýki af tegund 2 sem eru fluttir á sjúkrahús vegna umfangsmikilla skurðaðgerðar eða ef bráð alvarleg veikindi eru. Hefja má meðferð með Invocana ® ef ástand sjúklings er stöðugt.
Krabbameinsvaldandi áhrif og stökkbreytandi áhrif
Forklínískar upplýsingar sýna ekki sérstaka hættu fyrir menn, samkvæmt niðurstöðum lyfjafræðilegrar rannsókna á öryggi, eiturverkunum endurtekinna skammta, eiturverkunum á erfðaefni, eituráhrifum á æxlun og eituráhrifum á erfðaefni.
Frjósemi
Áhrif kanaglíflózíns á frjósemi hjá mönnum hafa ekki verið rannsökuð. Engin áhrif komu fram á frjósemi í dýrarannsóknum.
Blóðsykursfall við samtímis notkun með öðrum blóðsykurslækkandi lyfjum
Sýnt var fram á að notkun kanaglíflózíns sem einlyfjameðferð eða sem viðbót við blóðsykurslækkandi lyfjum (notkun þeirra fylgir ekki þróun blóðsykurslækkunar) leiddi sjaldan til blóðsykurslækkunar. Það er vitað að insúlín og blóðsykurslækkandi lyf sem auka seytingu þess (til dæmis sulfonylurea afleiður) valda þróun blóðsykursfalls. Þegar notkun kanaglíflózíns sem viðbótar við insúlínmeðferð eða með því að auka seytingu þess (til dæmis súlfónýlúreafleiður) var tíðni blóðsykurslækkunar hærri en með lyfleysu.
Til þess að draga úr hættu á blóðsykursfalli er mælt með því að minnka skammtinn af insúlíni eða lyfjum sem auka seytingu þess.
Lækkun rúmmáls í æð
Canagliflozin hefur þvagræsandi áhrif með því að auka útskilnað glúkósa í nýrum, sem veldur osmósu þvagræsingu, sem getur leitt til minnkaðs rúmmáls í æðum. Sjúklingar sem geta verið næmari fyrir aukaverkunum í tengslum við minnkun rúmmáls í æðum eru sjúklingar sem fá þvagræsilyf „lykkju“, sjúklingar með skerta nýrnastarfsemi í meðallagi alvarleika og sjúklingar á aldrinum> 75 ára.
Í klínískum rannsóknum á kanaglíflózíni kom oftar fram aukning á tíðni aukaverkana sem tengdust lækkun rúmmáls í æðum (t.d. svima, réttstöðuþrýstingsfall eða lágþrýstingur í slagæðum) oftar á fyrstu þremur mánuðunum þegar 300 mg af canagliflozin var notað. Á fyrstu sex vikum meðferðar með kanaglíflózíni voru tilvik um lítilsháttar meðalaukningu kreatíníns í sermi og samhliða lækkun á áætluðu GFR vegna minnkaðs rúmmáls í æð. Hjá sjúklingum sem höfðu tilhneigingu til meiri lækkunar á rúmmáli í æðum, eins og tilgreint er hér að ofan, var stundum umtalsverðari lækkun á GFR (> 30%) sem síðan var leyst og stundum þurfti truflun á meðferð með kanagliflozin.
Sjúklingar ættu að tilkynna klínísk einkenni um minnkað rúmmál í æðum. Þessar aukaverkanir leiddu sjaldan til þess að notkun kanaglíflózíns var hætt og oft með áframhaldandi notkun kanaglíflózíns var leiðrétt með breytingu á meðferð með því að taka blóðþrýstingslækkandi lyf (þ.mt þvagræsilyf). Hjá sjúklingum með minnkaða rúmmál í æðum, ætti að aðlaga þetta ástand áður en meðferð með canagliflozin er gefin. Áður en lyfinu Invokana er ávísað er nauðsynlegt að meta nýrnastarfsemi. Mælt er með að tíðara eftirlit sé með nýrnastarfsemi hjá sjúklingum með GFR minna en 60 ml / mín. / 1,73 m 2. Ekki má nota canagliflozin hjá sjúklingum með GFR minna en 45 ml / mín. / 1,73 m 2.
Gæta skal varúðar við notkun kanaglíflózíns hjá sjúklingum sem lækkun á blóðþrýstingi vegna töku lyfsins getur verið hætta á, til dæmis hjá sjúklingum með þekkta hjarta- og æðasjúkdóma, hjá sjúklingum með eGFR 2, hjá sjúklingum sem taka blóðþrýstingslækkandi lyf, með slagæðaþrýstingsfall í saga hjá sjúklingum sem taka þvagræsilyf í lykkju hjá öldruðum sjúklingum (> 65 ára).
Aukin blóðrauðagigt
Með hliðsjón af notkun kanaglíflózíns sást aukning á blóðrauðagigt, því skal gæta varúðar við notkun lyfsins hjá sjúklingum með aukinn blóðkornadrep.
Sveppasýking í kynfærum
Þar sem hömlun á natríumháðri glúkósa flutningsaðila fylgir aukning á útskilnaði glúkósa í nýrum, er greint frá tilvikum um bólgueyðandi bólgu í konum hjá konum og balanitis og balanoposthitis hjá körlum í klínískum rannsóknum. Sjúklingar (karlar og konur) sem höfðu sögu um sveppasýkingu í kynfærum voru líklegri til að þróa þessa sýkingu. Balanitis eða balanoposthitis myndaðist í fyrsta lagi hjá körlum sem ekki höfðu umskurn, einnig var greint frá tilfelli af phimosis. Í 0,2% tilvika gengust sjúklingar undir umskurð. Í flestum tilvikum var sýkingin meðhöndluð með staðbundnum sveppalyfjum sem læknir ávísaði eða tekinn á eigin spýtur á bak við áframhaldandi meðferð með kanaglíflózíni.
Hjartabilun
Reynsla af notkun lyfsins við langvarandi hjartabilun í III starfræksluflokknum (samkvæmt NYHA flokkuninni) er takmörkuð. Engin reynsla er af notkun lyfsins í langvinnri hjartabilun IV starfi (flokkun NYHA).
Áhrif á akstur og vinna með vélbúnaði
Ekki hefur verið sýnt fram á að kanaglíflózín getur haft áhrif á hæfni til aksturs ökutækja og vinna með verkunarhætti.Samt sem áður ættu sjúklingar að vera meðvitaðir um hættuna á blóðsykurslækkun þegar þeir nota canagliflozin sem viðbót við insúlínmeðferð eða lyf sem auka seytingu þess, aukna hættu á að fá aukaverkanir í tengslum við minnkað magn í æð (sundl í svölum) og skertri hæfni til að stjórna ökutæki og aðferðir til að þróa aukaverkanir.
Orlofskjör lyfjafræði
Framleiðandi
Framleiðsla á fullunnu skammtaforminu:
Janssen-Ortho LLC, 00778, State Road, 933 km 0.1 Maimi Ward, Gurabo, Puerto Rico.
Pökkun, pökkun og útblástursstjórnun:
Janssen-Silag S.p.A., Ítalíu,
Lögheimili: Cologno Monzeze, Mílanó, ul. M. Buonarotti, 23.
Raunverulegt heimilisfang: 04100, Borgo San Michele, Latina, ul. S. Janssen.
Handhafi skráningarskírteina, kröfuhafa
Johnson & Johnson LLC, Rússlandi, 121614, Moskvu, ul. Krylatskaya, 17/2
Þessi útgáfa af leiðbeiningunum gildir frá 04.29.2016