Mikardis 80 notkunarleiðbeiningar
Mikardis er framleitt í formi töflna: ílangar, næstum hvítir eða hvítir, á annarri hliðinni er leturgröftur „51N“ eða „52N“ (40 eða 80 mg, hver um sig), hins vegar - tákn fyrirtækisins (7 stk. Í þynnum, hvor um sig 2, 4, 8 eða 14 þynnur í pappakassa).
Samsetning 1 töflu inniheldur:
- Virkt efni: telmisartan - 40 eða 80 mg,
- Aukahlutir (40/80 mg hvor): magnesíumsterat - 4/8 mg, natríumhýdroxíð - 3,36 / 6,72 mg, meglúmín - 12/24 mg, pólývidón (kollidón 25) - 12/24 mg, sorbitól - 168,64 / 337,28 mg.
Slepptu formi
Lyfið er hvítar, ílangar töflur með 51H letri í annarri brún og merki fyrirtækisins á hinni brúninni.
7 slíkar töflur með 40 mg skammti í þynnupakkningu; 2 eða 4 slíkar þynnur í pappaöskju. Annaðhvort 7 slíkar töflur með 80 mg skammti í þynnupakkningu, 2, 4 eða 8 slíkar þynnur í pappaöskju
Lyfhrif og lyfjahvörf
Lyfhrif
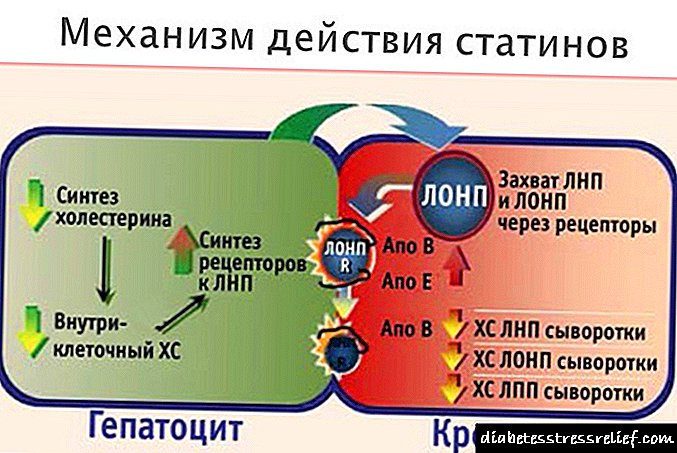
Telmisartan - sértækur viðtakablokkari angíótensín II. Hefur mikla hitabylgju í átt að AT1 viðtakategund angíótensín II. Keppir með angíótensín II í sérstökum viðtökum, sem hafa ekki sömu áhrif. Bindingin er stöðug.
Sýnir ekki aðrar undirtegundir viðtaka hitabelti. Dregur úr innihaldi aldósterón í blóði, bæla ekki renín og jónagöng í frumum.
Byrjaðu blóðþrýstingslækkandi áhrif fram á fyrstu þremur klukkustundunum eftir gjöf telmisartan. Aðgerðin er viðvarandi í einn dag eða meira. Áberandi áhrif þróast mánuði eftir stöðuga gjöf.
Hjá einstaklingum með slagæðarháþrýstingurtelmisartan lækkar slagbils og þanbilsþrýsting, en breytir ekki fjölda hjartasamdráttar.
Veldur ekki fráhvarfseinkennum.
Lyfjahvörf
Þegar það er tekið til inntöku frásogast það hratt úr þörmum. Aðgengi er að nálgast 50%. Eftir þrjár klukkustundir verður plasmaþéttni hámarks. 99,5% virka efnisins binst blóðpróteinum. Umbrotið með því að svara með glúkúrónsýra. Umbrotsefni lyfsins eru óvirk. Helmingunartími brotthvarfs er meira en 20 klukkustundir. Það skilst út um meltingarveginn, útskilnaður í þvagi er innan við 2%.
Frábendingar
Ekki má nota Micardis töflur hjá einstaklingum með ofnæmi á íhlutum lyfsins, þungur sjúkdómalifur eða nýrun, frúktósaóþol, á meðgöngu og brjóstagjöf, börn yngri en 18 ára.
Aukaverkanir
- Frá miðtaugakerfinu: þunglyndisundl höfuðverkurþreyta, kvíði, svefnleysi, krampar.
- Frá öndunarfærum: sjúkdómar í öndunarvegi (skútabólga, kokbólga, berkjubólga), hósta.
- Úr blóðrásarkerfinu: áberandi lækkun á þrýstingi, hraðtaktur, hægslátturbrjóstverkur.
- Frá meltingarfærum: ógleði, niðurgangur, meltingartruflanirauka styrk lifrarensíma.
- Frá stoðkerfi: vöðvaþráverkir í lágum baki liðverkir.
- Frá kynfærum: bjúgur, sýkingar í kynfærum, hækkun kreatininemia.
- Ofnæmisviðbrögð: Húðútbrot, ofsabjúgur, ofsakláði.
- Rannsóknarstofuvísar: blóðleysi, blóðkalíumlækkun.
- Annað: roðaþembakláði mæði.
Mikardis, notkunarleiðbeiningar
Samkvæmt leiðbeiningum um notkun Mikardis er lyfið tekið til inntöku. Mælt með fyrir fullorðna skammtur 40 mg einu sinni á dag. Hjá fjölda sjúklinga sést þegar meðferðaráhrif þegar skammtur er tekinn 20 mg á dag. Ef ekki er minnst á þrýstingi í viðeigandi stig er hægt að auka skammtinn í 80 mg á dag.
Hámarksáhrif lyfsins næst fimm vikum eftir upphaf meðferðar.
Hjá sjúklingum með alvarlegt form slagæðarháþrýstingur möguleg notkun 160 mg lyf á dag.
Samspil
Telmisartan virkjar blóðþrýstingslækkandi áhrif aðrar leiðir til að lækka þrýsting.
Þegar það er notað saman telmisartan og digoxín reglubundin ákvörðun á styrk er nauðsynleg digoxín í blóðinu, þar sem það getur aukist.
Þegar lyf eru tekin saman litíum og ACE hemlar tímabundin aukning á innihaldi gæti orðið vart litíum í blóði, sem birtist með eiturverkunum.
Meðferð bólgueyðandi lyf sem ekki eru sterar ásamt Mikardis hjá ofþornuðum sjúklingum getur leitt til þróunar bráðrar nýrnabilunar.
Sérstakar leiðbeiningar
Fyrir þurrkaðir sjúklingar (salt takmörkun, meðferð þvagræsilyf, niðurgangur, uppköst) lækkun á skammti af Mikardis er nauðsynleg.
Skipaðu einstaklingum með þrengsli af báðum nýrnaslagæða, míturlokuþrengsli eða ósæðarþrýstingsmeðferð með hjartavöðvakvilla hindrandi, alvarlegur nýrna-, lifrar- eða hjartabilun, sjúkdómar í meltingarveginum.
Það er bannað að nota hvenær aðal aldósterónismi og frúktósaóþol.
Með fyrirhugaðri meðgöngu verðurðu fyrst að finna skipti fyrir Mikardis með annarri blóðþrýstingslækkandi lyf.
Notið með varúð þegar ekið er.
Með samhliða notkun með lyfjum litíum sést eftirlit með litíuminnihaldi í blóði þar sem tímabundin hækkun á stigi þess er möguleg.
Mikardis verð
Í Rússlandi mun pakki með 80 mg nr. 28 kosta frá 830 til 980 rúblur. Í Úkraínu nálgast verð Mikardis í sama formi útgáfu 411 hryvni.
Í þessari grein geturðu lesið leiðbeiningar um notkun lyfsins Mikardis. Veitir athugasemdir frá gestum á vefnum - neytendum þessa lyfs, svo og áliti læknissérfræðinga um notkun Mikardis í starfi sínu. Stór beiðni er að bæta virklega við umsagnir þínar um lyfið: lyfið hjálpaði eða hjálpaði ekki til við að losna við sjúkdóminn, hvaða fylgikvillar og aukaverkanir komu fram, hugsanlega tilkynntu framleiðendur ekki í umsögninni. Mikardis hliðstæður í viðurvist fyrirliggjandi byggingarhliðstæðna. Notað til meðferðar á háþrýstingi og lækkun blóðþrýstings hjá fullorðnum, börnum, svo og á meðgöngu og við brjóstagjöf. Samsetning lyfsins.
Mikardis - blóðþrýstingslækkandi lyf.
Telmisartan (virka efnið lyfsins Mikardis) er sértækur mótlyf fyrir viðtaka angíótensíns 2. Það hefur mikla sækni í AT1 viðtaka undirgerð angíótensíns 2 þar sem angíótensín 2. er komið í framkvæmd. Telmisartan flytur angíótensín 2 frá viðtakanum, án verkunar á örva í tengslum við þennan viðtaka. Það myndar aðeins tengingu við AT1 viðtaka undirtegund angiotensin 2. Bindingin er stöðug. Telmisartan hefur ekki skyldleika við aðra viðtaka (þar með talið AT2 viðtaka) og aðra minna rannsakaða angíótensínviðtaka. Hagnýtur mikilvægi þessara viðtaka, svo og áhrif hugsanlegrar örvunar þeirra með angíótensíni 2, sem styrkur þeirra eykst við skipun telmisartans, hefur ekki verið rannsökuð. Það dregur úr styrk aldósteróns í blóði, hindrar ekki renín í blóðvökva og hindrar ekki jónagöng. Það hindrar ekki ACE (kínínasa 2), ensím sem eyðileggur einnig bradykinin, því er ekki gert ráð fyrir aukningu aukaverkana af völdum bradykinins.
Mikardis í 80 mg skammti hindrar fullkomlega háþrýstingsáhrif angíótensíns 2. Sýnt er að upphaf blóðþrýstingslækkandi áhrifa er innan 3 klukkustunda eftir fyrstu notkun telmisartans. Áhrif lyfsins vara í 24 klukkustundir og eru áfram marktæk í allt að 48 klukkustundir. Yfirlýst blóðþrýstingslækkandi áhrif myndast venjulega eftir 4-8 vikna reglulega notkun.
Hjá sjúklingum með slagæðarháþrýsting lækkar telmisartan slagbils- og þanbilsþrýstingur án þess að hafa áhrif á hjartsláttartíðni.
Ef um er að ræða skyndilega afpöntun á Mikardis snýr AD smám saman yfir í upphafsstig sitt án þess að þróa fráhvarfseinkenni.
Hýdróklórtíazíð (virka efnið í lyfinu Mikardis Plus) er þvagræsilyf af tíazíði. Þvagræsilyf af tíazíði hafa áhrif á endurupptöku raflausna í nýrnapíplum, sem eykur bein skilning á natríum og klóríðum (u.þ.b. jafngildi). Þvagræsandi áhrif hýdróklórtíazíðs leiða til lækkunar á bcc, aukinnar virkni reníns í plasma, aukningar á seytingu aldósteróns og fylgja aukning á kalíum í þvagi og bíkarbónötum og þar af leiðandi lækkun kalíums í blóðvökva. Við samtímis notkun telmisartans er tilhneiging til að stöðva tap kalíums af völdum þessara þvagræsilyfja, væntanlega vegna hömlunar á RAAS.
Eftir töku hýdróklórtíazíðs eykst þvagræsilyf eftir 2 klukkustundir og hámarksáhrif koma fram eftir um það bil 4 klukkustundir. Þvagræsandi áhrif lyfsins eru viðvarandi í um það bil 6-12 klukkustundir.
Langtíma notkun hýdróklórtíazíðs dregur úr hættu á fylgikvillum hjarta- og æðasjúkdóma og dánartíðni vegna þeirra.
Hámarks blóðþrýstingslækkandi áhrif lyfsins Mikardis Plus næst venjulega 4-8 vikum eftir að meðferð hefst.
Samsetning
Telmisartan + hjálparefni (Mikardis).
Telmisartan + hýdróklórtíazíð + hjálparefni (Mikardis Plus).
Lyfjahvörf
Þegar það er gefið frásogast telmisartan hratt úr meltingarveginum. Aðgengi er 50%. Þegar það er tekið samtímis mat, er lækkun á AUC gildum á bilinu 6% (þegar það er notað í 40 mg skammti) til 19% (þegar það er notað í 160 mg skammti). Eftir 3 klukkustundir eftir gjöf er styrkur í blóðvökva jafnaður óháð því hvenær át er. Það umbrotnar með samtengingu við glúkúrónsýru. Umbrotsefni eru ekki lyfjafræðilega virk. Það skilst út um þörmum óbreytt, útskilnaður um nýru - minna en 2% af skammtinum sem tekinn er.
Það er munur á styrk milli karla og kvenna. Hjá konum voru Cmax og AUC u.þ.b. 3 sinnum hærri en hjá körlum (án marktækra áhrifa á verkun).
Lyfjahvörf telmisartans hjá öldruðum sjúklingum eru ekki frábrugðin lyfjahvörfum hjá ungum sjúklingum. Ekki er þörf á aðlögun skammta.
Ekki er þörf á skammtabreytingum hjá sjúklingum með nýrnabilun, þar með talið sjúklinga í blóðskilun. Telmisartan er ekki fjarlægt með blóðskilun.
Hjá sjúklingum með skerta lifrarstarfsemi sem er vægt til í meðallagi gráðu (flokkur A og B á Child-Pugh kvarða), ætti dagskammtur lyfsins ekki að fara yfir 40 mg.
Helstu vísbendingar um lyfjahvörf telmisartans hjá börnum og unglingum á aldrinum 6 til 18 ára eftir að hafa tekið telmisartan í skammti sem var 1 mg / kg eða 2 mg / kg í 4 vikur eru almennt sambærilegir við gögn sem fengust við meðferð fullorðinna og staðfesta ólínulegt lyfjahvörf. telmisartan, sérstaklega með tilliti til Cmax.
Eftir inntöku næst Mikardis Plus Cmax hýdróklórtíazíð innan 1-3 klukkustunda. Heildaraðgengi er áætlað með uppsöfnuðum útskilnaði hýdróklórtíazíðs um nýru og er um 60%. Það binst plasmaprótein í blóði um 64%. Það umbrotnar ekki í mannslíkamanum og skilst út í þvagi nánast óbreytt. Um það bil 60% af skammtinum sem tekinn er til inntöku skilst út innan 48 klst.
Það er munur á plasmaþéttni hjá körlum og konum. Hjá konum er tilhneiging til klínískt marktækrar aukningar á plasmaþéttni hýdróklórtíazíðs.
Hjá sjúklingum með skerta nýrnastarfsemi minnkar brotthvarfshýdróklórtíazíð.
Vísbendingar
- slagæðarháþrýstingur (lækkun á þrýstingi),
- minnkun á hjarta- og æðasjúkdómum og dánartíðni hjá sjúklingum 55 ára og eldri sem eru í mikilli hættu á hjarta- og æðasjúkdómum.
Slepptu eyðublöðum
Töflur 40 mg og 80 mg.
Töflur 40 mg + 12,5 mg og 80 mg + 12,5 mg (Mikardis Plus).
Leiðbeiningar um notkun og skammta
Lyfinu er ávísað til inntöku, óháð fæðuinntöku.
Með slagæðarháþrýstingi er ráðlagður upphafsskammtur af Mikardis 1 tafla (40 mg) einu sinni á dag. Í þeim tilvikum sem lækningaáhrif nást ekki, er hægt að auka skammt lyfsins í 80 mg einu sinni á dag. Þegar tekin er ákvörðun um hvort auka eigi skammtinn skal hafa í huga að hámarks blóðþrýstingslækkandi áhrif næst venjulega innan 4-8 vikna eftir upphaf meðferðar.
Til að draga úr líkams- og æðasjúkdómum og dánartíðni er ráðlagður skammtur 1 tafla (80 mg) einu sinni á dag. Í upphafi meðferðar getur verið þörf á frekari leiðréttingu á blóðþrýstingi.
Ekki er krafist skammtaaðlögunar hjá sjúklingum með nýrnabilun (þ.mt blóðskilun).
Hjá sjúklingum með skerta lifrarstarfsemi sem er vægt til í meðallagi gráðu (flokkur A og B á Child-Pugh kvarða), ætti dagskammtur lyfsins ekki að fara yfir 40 mg.
Ekki þarf að breyta skömmtum hjá öldruðum sjúklingum.
Mikardis Plus ætti að taka til inntöku 1 sinni á dag, óháð fæðuinntöku.
Mikardis Plus 40 / 12,5 mg má ávísa sjúklingum þar sem notkun lyfsins Mikardis í 40 mg skammti eða hýdróklórtíazíði leiðir ekki til fullnægjandi stjórnunar á blóðþrýstingi.
Mikardis Plus 80 / 12,5 mg má ávísa sjúklingum þar sem notkun lyfsins Mikardis í 80 mg skammti eða Mikardis Plus 40 / 12,5 mg leiðir ekki til fullnægjandi stjórnunar á blóðþrýstingi.
Hjá sjúklingum með alvarlegan háþrýsting í slagæðum er hámarks dagsskammtur af telmisartani 160 mg á dag. Þessi skammtur var árangursríkur og þoldist vel.
Aukaverkanir
- öndunarörðugleikaheilkenni (þ.mt lungnabólga og lungnabjúgur),
- mæði
- hjartsláttartruflanir
- hraðtaktur
- hægsláttur
- veruleg lækkun á blóðþrýstingi (þ.mt réttstöðuþrýstingsfall),
- yfirlið
- náladofi
- svefntruflanir
- svefnleysi
- sundl
- kvíði
- þunglyndi
- pirringur
- höfuðverkur
- niðurgangur, hægðatregða,
- þurr slímhúð í munni,
- vindgangur
- kviðverkir
- uppköst
- magabólga
- minnkuð matarlyst
- lystarleysi
- blóðsykurshækkun
- kólesterólhækkun,
- brisbólga
- skert lifrarstarfsemi,
- gula (lifrarfrumum eða gallteppur),
- meltingartruflanir
- aukin svitamyndun
- bakverkir
- vöðvakrampar
- vöðvaþrá
- liðverkir,
- krampar í kálfa vöðva,
- liðagigt,
- Einkenni eins og sinabólga
- brjóstverkur
- járnskortsblóðleysi, vanmyndunarblóðleysi, blóðlýsublóðleysi, blóðflagnafæð, rauðkyrningafæð, hvítfrumnafæð, kyrningahrap, blóðflagnafæð,
- nýrnabilun, þ.mt bráð nýrnabilun,
- millivefslunga,
- glúkósamúría
- sjónskerðing
- skammvinn óskýr sjón
- bráð gláku með hornlokun,
- getuleysi
- blóðsýking, þ.mt banvæn tilfelli,
- sýkingar í efri öndunarvegi (berkjubólga, kokbólga, skútabólga),
- þvagfærasýkingar (þ.mt blöðrubólga),
- bólga í munnvatnskirtlum,
- aukin virkni lifrarensíma,
- aukin virkni CPK,
- aukinn styrkur þvagsýru í blóði,
- hækkun þríglýseríðs í blóði,
- blóðkalíumlækkun, blóðkalíumlækkun,
- blóðnatríumlækkun,
- blóðþurrð í blóði
- blóðsykurslækkun (hjá sjúklingum með sykursýki),
- skert glúkósaþol,
- minnkun blóðrauða í blóði,
- ofsabjúgur (þ.mt banvæn tilfelli),
- roðaþemba
- kláði í húð
- útbrot
- bráðaofnæmisviðbrögð,
- exem
- eiturlyf útbrot
- eitruð drep í húðþekju,
- lúpuslík viðbrögð
- versnun eða aukning á einkennum rauðra úlfa.
- drep í æðum,
- altæk æðabólga
- ljósnæmisviðbrögð,
- bakslag rauðra úlfa.
- æðabólga
- flensulík heilkenni
- hiti
- veikleiki.
Frábendingar
- hindrandi gallvegasjúkdómur
- verulega skert lifrarstarfsemi (Child-Pugh flokkur C),
- alvarleg nýrnastarfsemi (CC minna en 30 ml / mín.),
- eldfast blóðkalíumlækkun, kalsíumhækkun,
- samtímis notkun með aliskiren hjá sjúklingum með sykursýki og nýrnabilun (GFR minna en 60 ml / mín. / 1,73 m2),
- arfgengur frúktósaóþol (lyfið inniheldur sorbitól),
- laktasaskortur, laktósaóþol, vanfrásogsheilkenni glúkósa-galaktósa,
- allt að 18 ára aldri (öryggi og verkun ekki staðfest),
- meðgöngu
- brjóstagjöf (brjóstagjöf),
- ofnæmi fyrir virka efninu eða aukahlutum lyfsins eða öðrum súlfónamíðafleiðum.
- tvíhliða nýrnaslagæðarþrengsli eða slagæðaþrengsli í stökum nýrum,
- skerta lifrarstarfsemi eða versnandi lifrarsjúkdóm (flokkur A og B á Child-Pugh kvarða),
- lækkun á BCC vegna fyrri þvagræsimeðferðar, takmarkana á neyslu á salti, niðurgangi eða uppköstum,
- blóðkalíumlækkun
- ástand eftir ígræðslu nýrna (engin reynsla af notkun),
- langvarandi hjartabilun 3-4 FC samkvæmt flokkun New York Heart Association,
- þrengsli á ósæðar og míturloku,
- sjálfvakinn ofstækkun í slagæðarfrumum,
- blóðþrýstingslækkandi hjartavöðvakvilla,
- sykursýki
- aðal aldósterónismi,
- þvagsýrugigt
- horn-lokun gláku (vegna nærveru hýdróklórtíazíðs í samsetningunni).
Meðganga og brjóstagjöf
Ekki má nota Mikardis og Mikardis Plus á meðgöngu.
Ekki er mælt með notkun angíótensín 2 viðtakablokka á fyrsta þriðjungi meðgöngu, ekki ætti að ávísa þessum lyfjum á meðgöngu. Þegar þungun á sér stað, ætti að stöðva lyfið strax. Ef nauðsyn krefur, á að ávísa annarri meðferð (aðrir flokkar blóðþrýstingslækkandi lyfja sem eru samþykktir til notkunar á meðgöngu).
Ekki má nota angíótensín 2 viðtakablokka á 2. og 3. þriðjungi meðgöngu. Í forklínískum rannsóknum á telmisartani fannst vansköpunaráhrif ekki, en eiturverkanir á fóstur voru staðfestar. Það er vitað að áhrif angiotensin 2 viðtakablokka á 2. og 3. þriðjungi meðgöngu valda eiturverkunum á fóstur hjá einstaklingi (skert nýrnastarfsemi, oligohydramnios, seinkað beinmyndun höfuðkúpunnar), svo og eiturverkanir á nýbura (nýrnabilun, lágþrýstingur, blóðkalíumlækkun). Sjúklinga sem skipuleggja meðgöngu ættu að fá aðra meðferð. Ef meðferð með angíótensín 2 viðtakablokkum var framkvæmd á 2. þriðjungi meðgöngu er mælt með ómskoðun nýrna og höfuðkúpubeina fósturs.
Fylgjast skal náið með nýburum sem mæður fengu angíótensín 2 viðtakablokka með tilliti til slagæðaþrýstings.
Reynsla af hýdróklórtíazíði á meðgöngu, sérstaklega á fyrsta þriðjungi meðgöngu, er takmörkuð. Hýdróklórtíazíð fer yfir fylgju. Miðað við lyfjafræðilega verkunarmáta hýdróklórtíazíðs er gert ráð fyrir að notkun þess á 3. og 3. þriðjungi meðgöngu geti raskað fitubræðslu og valdið breytingum á fósturvísi og fóstri, svo sem gula, saltajafnvægi og blóðflagnafæð. Ekki ætti að nota hýdróklórtíazíð við bjúg þungaðra kvenna, handa þunguðum konum með slagæðarháþrýsting eða við pre-þunglyndi, eins og það er hætta á lækkun á plasmaþéttni og minnkun á flóð í fylgju og engin jákvæð áhrif eru í þessum klínískum aðstæðum.
Ekki ætti að nota hýdróklórtíazíð við meðhöndlun nauðsynlegs háþrýstings hjá þunguðum konum, nema í mjög sjaldgæfum tilvikum þar sem ekki er hægt að nota aðrar meðferðir.
Ekki má nota meðferð með lyfinu Mikardis og Mikardis Plus meðan á brjóstagjöf stendur.
Í dýrarannsóknum komu ekki fram áhrif telmisartans og hýdróklórtíazíðs á frjósemi.
Rannsóknir á áhrifum á frjósemi hjá mönnum hafa ekki verið gerðar.
Notist hjá börnum
Ekki má nota lyfin Mikardis og Mikardis Plus til notkunar hjá börnum og unglingum undir 18 ára aldri, vegna þess að upplýsingar um verkun og öryggi hjá þessum sjúklingahópi eru ekki tiltækar.
Notkun hjá öldruðum sjúklingum
Ekki er þörf á breytingum á skammtaáætlun hjá öldruðum sjúklingum.
Sérstakar leiðbeiningar
Aðstæður sem auka RAAS virkni
Hjá sumum sjúklingum er skert nýrnastarfsemi (þ.mt bráð nýrnabilun) vegna kúgunar á virkni RAAS, sérstaklega við samtímis gjöf lyfja sem virka á þetta kerfi. Þess vegna ætti að framkvæma meðferð samfara sams konar tvöföldum blokkun RAAS (til dæmis með ACE hemli eða beinum renínhemli, aliskiren, við angíótensín 2 viðtakablokka) sérstaklega og með reglulegu eftirliti með nýrnastarfsemi (þ.mt reglubundið eftirlit með kalíum og kalíum og kreatínín í sermi).
Notkun tíazíð þvagræsilyfja hjá sjúklingum með skerta nýrnastarfsemi getur leitt til azotemia. Mælt er með reglulegu eftirliti með nýrnastarfsemi.
Hjá sjúklingum með tvíhliða nýrnaslagæðarþrengingu eða slagæðarþrengingu í eina starfandi nýra, með notkun lyfja sem hafa áhrif á RAAS, er hættan á að fá alvarlegan lágþrýsting í slagæðum og nýrnabilun aukin.
Skert lifrarstarfsemi
Hjá sjúklingum með skerta lifrarstarfsemi eða versnandi lifrarsjúkdóm ætti að nota MikardisPlus með varúð þar sem jafnvel litlar breytingar á jafnvægi vatns og salta geta stuðlað að þróun lifrar coma.
Áhrif á umbrot og virkni innkirtla
Hjá sjúklingum með sykursýki kann að vera þörf á breytingu á skammti insúlíns eða blóðsykurslækkandi lyfja til inntöku. Meðan á meðferð með tíazíð þvagræsilyfjum stendur getur dulið sykursýki komið fram.
Í sumum tilvikum getur notkun tíazíð þvagræsilyfja valdið þvagsýrugigt og aukinni þvagsýrugigt.
Hjá sjúklingum með sykursýki og aukna áhættu á hjarta og æðakerfi, til dæmis hjá sjúklingum með sykursýki og kransæðahjartasjúkdóm, getur notkun lyfja sem lækka blóðþrýsting, svo sem angíótensín 2 viðtakablokka eða ACE hemla, aukið hættu á banvænum hjartadrepi og skyndilegum hjartaáfalli æðardauði. Hjá sjúklingum með sykursýki getur kransæðasjúkdómur verið einkennalaus og getur því verið ógreindur. Áður en byrjað er að nota lyfið Mikardis og Mikardis Plus til að greina og meðhöndla kransæðahjartasjúkdóm, skal gera viðeigandi greiningarrannsóknir, þ.m.t. próf með líkamsrækt.
Bráð nærsýni og gláku með hliðarhorni
Hýdróklórtíazíð, sem er súlfónamíðafleiða, getur valdið einkennalausum viðbrögðum í formi bráðrar skammvinnrar nærsýni og bráðrar gláku í hornhorni. Einkenni þessara kvilla eru óvænt minnkun á sjónskerpu eða augaverkjum, sem í dæmigerðum tilvikum kemur fram innan nokkurra klukkustunda til nokkurra vikna eftir upphaf lyfsins. Ef ómeðhöndlað getur bráð gláku með hornlokun leitt til sjónskerðingar. Aðalmeðferðin er að hætta hýdróklórtíazíði eins fljótt og auðið er. Hafa verður í huga að ef augnþrýstingur er ómeðhöndlaður, getur verið þörf á brýnni íhaldssöm eða skurðaðgerð. Áhættuþættir fyrir þróun bráðrar gláku í hornlokun eru saga um ofnæmi fyrir súlfónamíðum eða penicillíni.
Brot á jafnvægi vatns-salta
Þegar lyfið Mikardis Plus er notað, eins og þegar um er að ræða þvagræsimeðferð, er nauðsynlegt að fylgjast reglulega með innihaldi blóðsalta í blóðserminu.
Tíazíð þvagræsilyf, þ.m.t. hýdróklórtíazíð, getur valdið truflunum á jafnvægi vatns-salta og sýru-basa ástands (blóðkalíumlækkun, blóðnatríumlækkun og blóðklóríð basískri basa). Einkenni þessara sjúkdóma eru þurr slímhúð í munni, þorsti, almennur slappleiki, syfja, kvíði, vöðvaverkir eða krampakenndir kálfavöðvar (crumpi), vöðvaslappleiki, marktækur lækkun á blóðþrýstingi, oliguria, hraðtakti og svo meltingarvegi. meltingartruflanir eins og ógleði eða uppköst.
Þegar tíazíð þvagræsilyf eru notuð getur blóðkalíumlækkun myndast en telmisartan notað á sama tíma getur aukið kalíuminnihald í blóði. Hættan á blóðkalíumlækkun er mest aukin hjá sjúklingum með skorpulifur, með aukinni þvagræsingu, með saltfríu mataræði, svo og þegar um er að ræða samtímis notkun glúkó- og steinefnarstera eða barkstera. Telmisartan, sem er hluti af undirbúningi Mikardis og Mikardis Plus, þvert á móti, getur leitt til blóðkalíumlækkunar vegna mótvægis við angíótensín 2 viðtaka (undirtegund AT1). Þrátt fyrir að ekki hafi verið greint frá klínískt marktækum blóðkalíumlækkun við notkun Mikardis Plus, eru áhættuþættir fyrir þroska þess nýrna- og / eða hjartabilun og sykursýki.
Engar vísbendingar eru um að lyfið Mikardis Plus geti dregið úr eða komið í veg fyrir blóðnatríumlækkun af völdum þvagræsilyfja. Blóðsykurshækkun er venjulega lítil og þarfnast ekki meðferðar.
Tíazíð þvagræsilyf geta dregið úr útskilnaði kalsíums í nýrum og valdið (ef augljósar truflanir eru á umbroti kalsíums) tímabundna og lítilsháttar aukningu á kalsíum í sermi. Alvarlegri blóðkalsíumlækkun getur verið merki um dulda ofstarfsemi skjaldkirtils. Hætta skal tíazíð þvagræsilyfjum áður en metið er virkni skjaldkirtils.
Sýnt hefur verið fram á að tíazíð þvagræsilyf auka útskilnað magnesíums í nýrum, sem getur leitt til blóðmagnesíumlækkunar.
Hjá sjúklingum með kransæðahjartasjúkdóm getur notkun hvers konar blóðþrýstingslækkandi lyfja, ef um er að ræða of mikinn blóðþrýstingslækkun, leitt til hjartadreps eða heilablóðfalls.
Tilkynnt hefur verið um þróun systemic lupus erythematosus með þvagræsilyfjum af tíazíði.
Ef nauðsyn krefur er hægt að nota Mikardis og Mikardis Plus samtímis öðrum blóðþrýstingslækkandi lyfjum.
Vanstarfsemi lifrar við skipun telmisartans kom í flestum tilvikum fram meðal íbúa í Japan.
Áhrif á hæfni til aksturs ökutækja og stjórnkerfi
Sérstakar klínískar rannsóknir til að meta áhrif lyfsins Mikardis Plus á hæfni til aksturs ökutækja og vinna með verkunarháttum sem krefjast aukinnar athygli hafa ekki verið gerðar. Þegar ekið er og stundað hættulegar athafnir skal þó taka tillit til möguleikans á svima og syfju sem krefst varúðar.
Lyfjasamskipti
Samtímis notkun telmisartans ásamt:
- önnur blóðþrýstingslækkandi lyf geta aukið blóðþrýstingslækkandi áhrif. Í einni rannsókn, ásamt samhliða notkun telmisartans og ramipríls, sást 2,5-föld aukning á AUC0-24 og Cmax af ramipril og ramipril. Klínískt mikilvægi þessarar milliverkunar hefur ekki verið staðfest. Greining á aukaverkunum sem leiddi til þess að meðferð var hætt og greining á alvarlegum aukaverkunum sem fengust við klínísku rannsóknina leiddi í ljós að líklegra var að hósta og ofsabjúgur komi fram við ramipril en slagæðaþrýstingsfall var algengara með telmisartan. Tilfelli blóðkalíumlækkunar, nýrnabilunar, slagæðaþrýstings og yfirliðs sáust marktækt oftar við samtímis notkun telmisartans og ramipríls,
- litíumblöndur bentu til afturkræfra aukningar á styrk litíums í blóði, ásamt eiturverkunum með notkun ACE hemla. Í mjög sjaldgæfum tilvikum hefur verið greint frá slíkum breytingum við gjöf angiotensin 2 viðtakablokka, einkum telmisartans. Við samtímis notkun litíumsambands og angíótensín 2 viðtakablokka er mælt með því að ákvarða litíuminnihald í blóði,
- bólgueyðandi gigtarlyf (NSAID), þ.mt asetýlsalisýlsýra í skömmtum sem notuð eru sem bólgueyðandi lyf, COX-2 hemlar og ósértækir bólgueyðandi gigtarlyf, geta valdið bráðum nýrnabilun hjá sjúklingum með skerta BCC. Lyf sem hafa áhrif á RAAS geta haft samverkandi áhrif. Hjá sjúklingum sem fá bólgueyðandi gigtarlyf og telmisartan á að bæta upp BCC við upphaf meðferðar og gera ætti rannsókn á nýrnastarfsemi. Minnkun á áhrifum blóðþrýstingslækkandi lyfja, svo sem telmisartans, með því að hindra æðavíkkandi áhrif prostaglandína, ásamt samhliða meðferð með bólgueyðandi gigtarlyfjum. Við samtímis notkun telmisartans með íbúprófeni eða parasetamóli fundust engin klínískt marktæk áhrif,
- digoxín, warfarín, hýdróklórtíazíð, glíbenklamíð, simvastatín og amlodipin leiddu ekki í ljós klínískt marktækar milliverkanir. Marktæk aukning á meðalstyrk digoxíns í blóðvökva um 20% að meðaltali (í einu tilviki um 39%). Við samtímis gjöf telmisartans og digoxins er mælt með því að ákvarða reglulega styrk digoxins í blóði.
Samtímis notkun með:
- etanól (áfengi), barbitúröt eða ópíóíð verkjalyf, það er hætta á myndun réttstöðuþrýstingsfalls,
- blóðsykurslækkandi lyf til inntöku og insúlín getur þurft að aðlaga skammta blóðsykurslækkandi lyfja til inntöku og insúlíns,
- metformín er hætta á mjólkursýrublóðsýringu,
- kolestiraminom og kolestipolom - í viðurvist anjónaskipta kvoða raskast frásog hýdróklórtíazíðs,
- hjartaglýkósíð eykur hættuna á að fá blóðkalíumlækkun eða blóðmagnesíumlækkun af völdum tíazíð þvagræsilyfja, þróun hjartsláttartruflana af völdum hjartaglýkósíðs,
- pressóramín (t.d. noradrenalín) geta veikt áhrif pressóramína,
- vöðvaslakandi lyf sem ekki eru afskautandi (t.d. tubocurarine klóríð) hýdróklórtíazíð geta aukið áhrif vöðvaslakandi lyfja sem ekki eru afskautandi,
- antigout lyf geta aukið styrk þvagsýru í blóðinu og þess vegna getur verið þörf á breytingum á skammti þvagfærasjúkdóma. Notkun þvagræsilyfja af tíazíði eykur tíðni þroska ofnæmisviðbragða fyrir allópúrínóli,
- kalsíumblöndur - þvagræsilyf af tíazíði geta aukið kalsíuminnihald í sermi vegna minnkaðs útskilnaðar í nýrum. Ef þú vilt nota kalsíumblöndur, ættir þú reglulega að fylgjast með kalsíuminnihaldinu í blóði og, ef nauðsyn krefur, breyta skammtinum af kalsíumblöndunum,
- beta-blokkar og díazoxíð tíazíð þvagræsilyf geta aukið blóðsykurshækkun af völdum beta-blokka og díoxoxíðs,
- m-andkólínvirk lyf (til dæmis atrópín, biperidín) - lækkun á hreyfigetu í meltingarvegi, aukning á aðgengi tíazíð þvagræsilyfja,
- amantadín tíazíð þvagræsilyf geta aukið hættuna á aukaverkunum af völdum amantadins,
- frumudrepandi lyf (til dæmis sýklófosfamíð, metótrexat) - lækkun á útskilnaði frumudrepandi lyfja um nýru og aukning á mergbælandi áhrifum þeirra,
- Bólgueyðandi gigtarlyf - samtímis notkun tíazíð þvagræsilyfja getur leitt til lækkunar á þvagræsilyfjum og blóðþrýstingslækkandi áhrifum,
- lyf sem leiða til brotthvarfs kalíums og kalíumskorts (til dæmis þvagræsilyfja sem fjarlægja kalíum, hægðalyf, glúkó- og steinefni barkstera, kortikótrópín, amfótericín B, karbenoxólón, bensýlpenicillín, afleiður asetýlsalisýlsýru) - aukin hypokalemic áhrif. Blóðkalíumlækkun af völdum hýdróklórtíazíðs vegur upp á móti kalíumsparandi áhrifum telmisartans,
- þróun blóðkalíumlækkunar er möguleg með kalíumsparandi þvagræsilyfjum, kalíumblöndu, öðrum leiðum sem geta aukið kalíuminnihald í sermi (til dæmis heparín) eða skipt út natríum í natríumklóríði með kalíumsöltum. Mælt er með reglulegu eftirliti með kalíum í blóði í þeim tilvikum þar sem lyfið Mikardis Plus er notað samtímis lyfjum sem geta valdið blóðkalíumlækkun, svo og með lyfjum sem geta aukið kalíum í sermi.
Hliðstæður af lyfinu Mikardis
Uppbyggingarhliðstæður virka efnisins:
Analogar í lyfjafræðilegum hópi (angiotensin 2 viðtakablokkar):
- Angíakand
- Móta
- Atacand
- Blocktran
- Vasotens,
- Valz
- Valsartan
- Valsafors,
- Valsacor
- Hyposart,
- Diovan
- Zisakar
- Ibertan
- Irbesartan
- Irsar
- Candecor
- Candesartan
- Cardosal
- Cardosten
- Cardostin
- Karzartan
- Cozaar
- Xarten
- Lakea
- Lozap,
- Lozarel
- Losartan
- Lorista
- Losacor
- Lotor
- Mikardis Plus,
- Naviten
- Nortian
- Olimestra
- Ordiss
- Rofi
- Presartan
- Renicard
- Sartavel
- Tanidol
- Tantordio
- Tareg
- Teveten
- Þessir,
- Telzap
- Telmisartan
- Telmista
- Telsartan
- Firmast
- Edarby.
Skráningarnúmer: P N015387 / 01
Verslunarheiti lyfsins: Mikardis ®
Alþjóðlegt heiti nonproprietary (INN): telmisartan
Skammtaform: töflur
Samsetning: 1 tafla inniheldur:
Virkt efni: - Telmisartan 40 mg eða 80 mg,
Hjálparefni: - natríumhýdroxíð 3,36 mg / 6,72 mg, polyvidon (Kollidon 25) 12 mg / 24 mg, meglumín 12 mg / 24 mg, sorbitól 168,64 mg / 337,28 mg, magnesíumsterat 4 mg / 8 mg
Lýsing
40 mg töflur
Hvítar eða næstum hvítar ílangar töflur, á annarri hliðinni grafa „51H“, á hinni hliðinni - tákn fyrirtækisins.
80 mg töflur
Hvítar eða næstum hvítar ílangar töflur, á annarri hliðinni grafa „52H“, á hinni hliðinni - tákn fyrirtækisins.
Flokkun eftir verkun: angíótensín II viðtakablokki.
ATX kóða C09CA07
Lyfjafræðilegir eiginleikar
Lyfhrif
Telmisartan er sértækur angíótensín II viðtakablokki (tegund AT1), virkur þegar hann er tekinn til inntöku. Það hefur mikla sækni í AT1 undirtegund angíótensín II viðtaka þar sem verkun angíótensíns II verður að veruleika. Fjarlægir angíótensín I frá tengslum við viðtakann en hefur ekki verkun örva í tengslum við þennan viðtaka.
Telmisartan binst aðeins við AT1 undirtegund angíótensín II viðtaka. Tengingin er stöðug. Það hefur ekki skyldleika við aðra viðtaka, þar með talið AT2 viðtakann og aðra minna rannsakaða angíótensínviðtaka. Hagnýtur mikilvægi þessara viðtaka, svo og áhrif hugsanlegrar örvunar þeirra með angíótensíni II, sem styrkur þeirra eykst við skipun telmisartans, hefur ekki verið rannsökuð. Það dregur úr styrk aldósteróns í blóði, hindrar ekki renín í blóðvökva og hindrar ekki jónagöng. Telmisartan hindrar ekki angíótensínbreytandi ensímið (kininase II) (ensím sem brýtur einnig niður bradykinin). Þess vegna er ekki gert ráð fyrir aukningu á aukaverkunum af völdum bradykinins.
Hjá sjúklingum hindrar telmisartan í 80 mg skammti fullkomlega háþrýstingsáhrif angíótensíns II. Fram kemur að lágþrýstingslækkandi verkun er gerð innan 3 klukkustunda eftir fyrstu gjöf telmisartans. Áhrif lyfsins eru viðvarandi í 24 klukkustundir og eru enn marktæk allt að 48 klukkustundir. Áberandi blóðþrýstingslækkandi áhrif þróast venjulega 4-8 vikum eftir reglulega inntöku.
Hjá sjúklingum með slagæðarháþrýsting lækkar telmisartan slagbils- og þanbilsþrýstingur (BP) án þess að hafa áhrif á hjartsláttartíðni (HR).
Ef um er að ræða skyndilega niðurfellingu telmisartans snýr blóðþrýstingur smám saman upp í upphafsstig sitt án þess að þróa „afpöntunarheilkenni“.
Lyfjahvörf
Þegar það er tekið til inntöku frásogast það hratt úr meltingarveginum. Aðgengi -50%. Þegar það er tekið samtímis mat, þá lækkar AUC (svæði undir styrk-tíma ferlinum) frá 6% (í 40 mg skammti) til 19% (í 160 mg skammti). 3 klukkustundum eftir inntöku, styrkur styrkur í blóði í plasma, óháð máltíðinni. Það er munur á plasmaþéttni hjá körlum og konum. Cmax (hámarksstyrkur) og AUC voru um það bil 3 og 2 sinnum, hvort um sig, hærri hjá konum samanborið við karla án marktækra áhrifa á verkun.
Samskipti við plasmaprótein í blóði - 99,5%, aðallega með albúmíni og alfa-1 glýkópróteini.
Meðalgildi sýnilegs dreifingarrúmmáls í jafnvægisstyrk er 500 lítrar. Það umbrotnar með samtengingu við glúkúrónsýru. Umbrotsefni eru lyfjafræðilega óvirk. Helmingunartími brotthvarfs (T½) er meira en 20 klukkustundir. Það skilst út um þörmum óbreytt, útskilnaður um nýru - innan við 2%. Heildarplasmaúthreinsun er mikil (900 ml / mín.) Samanborið við „blóðflæði“ í lifur (um 1500 ml / mín.).
Aldraðir sjúklingar
Lyfjahvörf telmisartans hjá öldruðum sjúklingum eru ekki frábrugðin ungum sjúklingum. Ekki er þörf á skammtaaðlögun.
Sjúklingar með nýrnabilun
Ekki er þörf á skammtabreytingum hjá sjúklingum með nýrnabilun, þar með talið sjúklinga í blóðskilun.
Telmisartan er ekki fjarlægt með blóðskilun.
Sjúklingar með lifrarbilun
Hjá sjúklingum með væga til miðlungsmikla skerðingu á lifrarstarfsemi (flokkur A og B á Child-Pugh kvarðanum) ætti dagskammturinn ekki að fara yfir 40 mg.
Hjá börnum
Helstu vísbendingar um lyfjahvörf telmisartans hjá börnum á aldrinum 6 til 18 ára, almennt, eru sambærilegar við gögn sem fengust við meðferð fullorðinna og staðfesta ólínuleiki lyfjahvörf telmisartans, sérstaklega í tengslum við Cmax.
Ábendingar til notkunar
- Arterial háþrýstingur.
- Skert hjarta- og æðasjúkdóma og dánartíðni hjá sjúklingum 55 ára og eldri með mikla hættu á hjarta- og æðasjúkdómum.
Frábendingar
- Ofnæmi fyrir virka efninu eða aukahlutum lyfsins
- Meðganga
- Brjóstagjöf
- Hindrandi sjúkdómar í gallvegum
- Veruleg skerðing á lifrarstarfsemi (Child-Pugh flokkur C)
- Arfgengur frúktósaóþol (inniheldur sorbitól)
- Aldur upp í 18 ár (verkun og öryggi ekki staðfest)
Með umhyggju
- Tvíhliða nýrnaslagæðarþrengsli eða slagæðaþrengsli í stökum nýrum,
- Skert lifrar- og / eða nýrnastarfsemi (sjá einnig Sérstakar leiðbeiningar),
- Lækkað blóðrúmmál í blóðrás (BCC) vegna fyrri þvagræsimeðferðar, takmörkun á salti, niðurgangi eða uppköstum
- Blóðnatríumlækkun,
- Blóðkalíumlækkun
- Aðstæður eftir ígræðslu nýrna (engin reynsla af notkun),
- Langvinn hjartabilun
- Þrengsli ósæðar og míturloku,
- Sjálfvakinn ofstækkun í slagæðarfrumum,
- Aðal aldósterónheilkenni (verkun og öryggi ekki staðfest)
Skammtar og lyfjagjöf
Inni, óháð máltíðinni.
Arterial háþrýstingur
Upphaflegur ráðlagður skammtur af lyfinu Mikardis ® er 1 flipi. (40 mg) einu sinni á dag. Í þeim tilvikum sem lækningaáhrifum er ekki náð, má auka hámarks ráðlagðan skammt af lyfinu Mikardis ® í 80 mg einu sinni á dag. Þegar tekin er ákvörðun um hvort auka eigi skammtinn skal hafa í huga að hámarks blóðþrýstingslækkandi áhrif næst venjulega innan 4-8 vikna eftir upphaf meðferðar.
Fækkun á hjarta- og æðasjúkdómum og dánartíðni
Ráðlagður skammtur er 1 tafla af lyfinu Mikardis 80 mg, ég einu sinni á dag.
Í upphafi meðferðar getur verið þörf á frekari leiðréttingu á blóðþrýstingi.
Skert nýrnastarfsemi
Hjá sjúklingum með nýrnabilun, þar með talið sjúklinga sem eru í blóðskilun, er ekki þörf á aðlögun skammta.
Skert lifrarstarfsemi
Hjá sjúklingum með væga til miðlungsmikla skerðingu á lifrarstarfsemi (flokkur A og B á Child-Pugh kvarðanum, í sömu röð), ætti dagskammtur Mikardis ® ekki að fara yfir 40 mg.
Aldraðir sjúklingar
Ekki þarf að breyta skömmtum.
Aukaverkanir
Tilfelli aukaverkana sem komu fram voru ekki í samræmi við kyn, aldur eða kynþátt sjúklinganna.
Sýkingar:
Sepsis, þ.mt banvæn blóðsýkingar, þvagfærasýking (þ.mt blöðrubólga), sýking í efri öndunarvegi.
Úr blóðrás og eitlum:
Blóðleysi, rauðkyrningafæð, blóðflagnafæð.
Frá miðtaugakerfinu:
Kvíði, svefnleysi, þunglyndi, yfirlið.
Frá líffærum sjón og heyrn:
Sjóntruflanir, sundl.
Úr hjarta- og æðakerfi:
Hægsláttur, hraðtaktur, greinileg lækkun á blóðþrýstingi, réttstöðuþrýstingsfalli
Frá öndunarfærum:
Mæði.
Úr meltingarfærum:
Kviðverkir, niðurgangur, munnþurrkur, meltingartruflanir, vindgangur, óþægindi í maga, uppköst, skert lifrarstarfsemi.
Ofnæmisviðbrögð:
Bráðaofnæmisviðbrögð, ofnæmi fyrir virka efninu eða aukahlutum lyfsins, ofsabjúgur (banvæn), exem, roði, kláði í húð, útbrot (þ.mt lyf), ofsvitnun, ofsakláði, eitruð útbrot.
Frá stoðkerfi:
Liðverkir, bakverkir, vöðvakrampar (krampar í kálfavöðvunum), verkir í neðri útlimum, vöðvaverkir, verkir í sinum (einkenni svipuð einkennum sinabólgu).
Frá nýrum og þvagfærum:
Skert nýrnastarfsemi, þ.mt bráð nýrnabilun.
Almennt:
Brjóstverkur, flensulík heilkenni, þróttleysi (veikleiki), blóðkalíumlækkun, blóðsykurslækkun (hjá sjúklingum með sykursýki).
Rannsóknarstofuvísar:
Lækkun á styrk blóðrauða, aukning á styrk þvagsýru, kreatíníni í blóði, aukning á virkni „lifrarensíma, aukning á styrk kreatín fosfókínasa (CPK).
Ofskömmtun
Engin tilvik ofskömmtunar hafa verið greind.
Einkenni: greinileg lækkun á blóðþrýstingi, hraðtaktur, hægsláttur.
Meðferð: meðferð með einkennum, blóðskilun er ekki árangursrík.
Milliverkanir við önnur lyf
Telmisartan getur aukið blóðþrýstingslækkandi áhrif annarra blóðþrýstingslækkandi lyfja. Aðrar tegundir milliverkana sem hafa klíníska þýðingu hafa ekki verið greindar. Samsett notkun með digoxíni, warfaríni, hýdróklórtíazíði, glíbenklamíði, íbúprófeni, parasetamóli, simvastatíni og amlodipini leiðir ekki til klínískt marktækra milliverkana. Marktæk aukning á meðalstyrk digoxíns í blóðvökva um 20% að meðaltali (í einu tilviki um 39%). Við samtímis gjöf telmisartans og digoxins er mælt með því að ákvarða reglulega styrk digoxins í blóði.
Við samtímis notkun telmisartan og ramipril sást aukning á AUC0-24 og Cmax ramipril og ramiprilat 2,5 sinnum. Klínískt mikilvægi þessa fyrirbæra hefur ekki verið staðfest.
Við samtímis gjöf angíótensínbreytandi ensíma (ACE) hemla og litíumblöndu sáust afturkræf aukning á styrk litíums í blóði, ásamt eiturverkunum. Í mjög sjaldgæfum tilvikum hefur verið greint frá slíkum breytingum við gjöf angíótensín II viðtakablokka. Við samtímis gjöf litíums og angíótensín II viðtakablokka er mælt með því að ákvarða styrk litíums í blóði.
Meðferð með bólgueyðandi gigtarlyfjum (NSAID), þ.mt asetýlsalisýlsýru, sýklóoxýgenasa-2 hemlum (COX-2) og ósértækum bólgueyðandi gigtarlyfjum, geta valdið bráðum nýrnabilun hjá þurrkuðum sjúklingum. Lyf sem verka á renín-angíótensín-aldósterón kerfið (RAAS) geta haft samverkandi áhrif. Hjá sjúklingum sem fá bólgueyðandi gigtarlyf og telmisartan þarf að bæta bcc við upphaf meðferðar og hafa eftirlit með nýrnastarfsemi.
Lækkun á áhrifum blóðþrýstingslækkandi lyfja, svo sem telmisartans, hefur komið í veg fyrir æðavíkkandi áhrif prostaglandína við samhliða meðferð með bólgueyðandi gigtarlyfjum.
Sérstakar leiðbeiningar
Hjá sumum sjúklingum er skert nýrnastarfsemi (þ.mt bráð nýrnabilun), vegna kúgun RAAS, sérstaklega þegar þeir nota samsetta lyf sem verkar á þetta kerfi. Þess vegna ætti að fara fram meðferð ásamt slíkri tvöföldri hömlun á RAAS nákvæmlega hver fyrir sig og með vandlegu eftirliti með nýrnastarfsemi (þ.mt reglubundið eftirlit með styrk kalíums og kreatíníns í sermi).
Í tilfellum háðs æðartónni og nýrnastarfsemi aðallega af RAAS virkni (til dæmis hjá sjúklingum með langvarandi hjartabilun, eða nýrnasjúkdóm, þar með talið nýrnaslagæðarþrengsli, eða slagæðarsjúkdóm í stökum nýrum), skipun lyfja sem hafa áhrif á þetta kerfi, getur fylgt þróun bráðs slagæðarþrýstings, ofvöxt í blóði, oliguria og í mjög sjaldgæfum tilvikum bráð nýrnabilun.
Byggt á reynslunni af notkun annarra lyfja sem hafa áhrif á RAAS, með samhliða notkun lyfsins Mikardis ® og kalíumsparandi þvagræsilyfjum, kalíum sem innihalda aukefni, kalíum sem innihalda ætur salt og önnur lyf sem auka styrk kalíums í blóði (til dæmis heparín), ætti að fylgjast með þessum vísir hjá sjúklingum.
Að öðrum kosti er hægt að nota Mikardis ® ásamt tíazíð þvagræsilyfjum, svo sem hýdróklórtíazíði, sem að auki hafa lágþrýstingsáhrif (til dæmis, Mikardis Plus ® 40 mg / 12,5 mg, 80 mg /) 2,5 mg).
Hjá sjúklingum með alvarlegan háþrýsting í slagæðum var skammturinn af telmisartan 160 mg / sólarhring og í bland við hýdróklórtíazíð 12,5-25 mg þoldist og árangursríkur. Mikardis ® er ekki eins árangursríkt hjá sjúklingum í Negroid kappakstrinum.
Áhrif á getu til að keyra bíl og vinna með vélbúnaði
Sérstakar klínískar rannsóknir á áhrifum lyfsins á hæfni til aksturs bifreiðar og fyrirkomulag hafa ekki verið gerðar. Hins vegar, þegar ekið er og unnið með búnað, skal þó taka tillit til möguleikans á svima og syfju sem krefst varúðar.
Slepptu formi
Töflur 40 mg og 80 mg.
7 töflur í hverri þynnu úr pólýamíði / áli / PVC. 2 eða 4 þynnur með leiðbeiningum um notkun í pappaöskju (í 40 mg skammti). Fyrir 2, 4 eða 8 þynnur með leiðbeiningum um notkun í pappaöskju (í 80 mg skammti).
Geymsluaðstæður
Listi B.
Geymið við hitastig sem er ekki hærra en 30 ° C á stað sem er varinn fyrir raka.
Geymið þar sem börn ná ekki til!
Gildistími
4 ár Notið ekki eftir fyrningardagsetningu.
Orlofskjör lyfjafræði
Eftir lyfseðli.
Nafn og heimilisfang lögaðila sem nafn skráningarvottorðsins er gefið út í
Beringer Ingelheim International GmbH Bingsr Strasse 173,
55216, Ingelheim am Rhein, Þýskalandi
Framleiðandi
Beringer Ingelheim Pharma GmbH & Co.KG
Bingerstrasse 173, 55216 Ingelheim am Rhein, Þýskalandi
Þú getur fengið viðbótarupplýsingar um lyfið, sem og sent kvartanir og upplýsingar um aukaverkanir á eftirfarandi heimilisfang í Rússlandi
Beringer Ingelheim LLC 125171, Moskva, Leningradskoye Shosse, 16A bls. 3
Skammtaform
Töflur 80 mg / 12,5 mg, 80 mg / 25 mg
Ein tafla inniheldur
virk efni: telmisartan 80 mg
hýdróklórtíazíð 12,5 mg eða 25 mg, hvort um sig
hjálparefni: natríumhýdroxíð, pólývidón K 25 (póvídón), meglúmín, sorbitól, magnesíumsterat, laktósaeinhýdrat, örkristölluð sellulósa, maíssterkja, járn (III) rautt oxíð (E172) (fyrir skammta 80 / 12,5), járn (ІІІ) oxíðgult (Е172) (fyrir skammta 80/25), natríum sterkju glýkólat (tegund A).
80 mg / 12,5 mg: sporöskjulaga spjaldtölvur með tvíkúptu yfirborði, tveggja laga: annað lagið er hvítt á litinn með „H8“ prenti og fyrirtækismerki, með leyfilegt innifalið af rauðu, hitt lagið er bleikt.
80 mg / 25 mg: sporöskjulaga töflur með tvíkúptu yfirborði, tveggja laga: annað lagið er hvítt með „H9“ prenti og fyrirtækismerki, með viðunandi gulum skvettum, hitt lagið er gult.
Lyfjafræðilegir eiginleikar
Lyfjahvörf
Samtímis notkun hýdróklórtíazíðs og telmisartans hefur ekki áhrif á lyfjahvörf þessara lyfja.
Telmisartan: eftir inntöku frásogast telmisartan hratt, hámarksstyrkur telmisartans næst eftir 0,5-1,5 klst.
Meðaltal heildaraðgengis telmisartans er um 50%. Að borða dregur lítið úr aðgengi telmisartans með lækkun á svæðinu undir ferlinum „plasmaþéttni tími“ (AUC) úr 6% þegar það er tekið í 40 mg skammti til 19% þegar það er tekið í 160 mg skammti. 3 klukkustundum eftir að telmisartan er tekið er stöðugleiki í blóðvökva stöðugur og fer ekki eftir fæðuinntöku. Lítilsháttar lækkun á AUC veldur ekki lækkun á verkun.
Lyfjahvörf telmisartans þegar þau eru tekin til inntöku eru ekki línuleg í skömmtum frá 20 mg til 160 mg með meira en hlutfallslegri aukningu á plasmaþéttni (Cmax og AUC) með auknum skammti. Telmisartan safnast ekki upp í blóðvökva að miklu leyti við endurtekna notkun.
Hýdróklórtíazíð: eftir inntöku næst hámarksstyrkur hýdróklórtíazíðs um það bil 1,0-3,0 klukkustundum eftir gjöf. Heildaraðgengi hýdróklórtíazíðs er um það bil 60%.
Telmisartan: hefur mikla bindingu við plasmaprótein (> 99,5%), aðallega með albúmíni og alfa-1 sýru glýkópróteini. Dreifingarrúmmál er um það bil 500 lítrar.
Hýdróklórtíazíð: 64% bundið plasmapróteinum og greinilegt dreifingarrúmmál þess er 0,8-0,3 l / kg.
Umbrot og útskilnaður
Telmisartan: eftir inntöku 14C-merktra telmisartans, var mestur skammturinn (> 97%) skilinn út í hægðum með galli útskilnað og mjög lítið magn fannst í þvagi. Það er umbrotið með því að samtengja byrjunarefnið með lyfjafræðilega óvirku asýlglukúróníði, eina glúkúróníðinu sem þekkist í mönnum.
Eftir gjöf staks skammts af 14C-merktu telmisartani greinist glúkúróníð í um það bil 11% af mældri geislavirkni í plasma. Cýtókróm P450 ísóensím taka ekki þátt í umbrotum telmisartans. Heildarplasmaúthreinsun telmisartans er um það bil 1500 ml / mín., Lokahelmingunartími er meira en 20 klukkustundir.
Hýdróklórtíazíð: hjá mönnum, það er ekki umbrotið og skilst út nær óbreytt í þvagi. Um það bil 60% af skammti til inntöku skilst út sem óbreytt efni innan 48 klukkustunda. Nýrnaúthreinsun er um það bil 250-300 ml / mín. Lokahelmingunartími hýdróklórtíazíðs er 10-15 klukkustundir.
Aldraðir sjúklingar: lyfjahvörf telmisartans hjá öldruðum sjúklingum og yngri en 65 ára eru ekki frábrugðin.
Kyn: plasmaþéttni telmisartans hjá konum er 2-3 sinnum hærri en hjá körlum. Í klínískum rannsóknum var þó engin marktæk hækkun á blóðþrýstingi eða tíðni réttstöðuþrýstingsfalls hjá konum. Ekki er þörf á aðlögun skammta. Tilhneiging var til hærri styrks hýdróklórtíazíðs í blóði hjá konum samanborið við karla.
Engin klínískt marktæk uppsöfnun telmisartans fannst.
Sjúklingar með nýrnabilun
Útskilnaður um nýru hefur ekki áhrif á úthreinsun telmisartans. Byggt á reynslu af notkun lyfsins hjá sjúklingum með væga til miðlungsmikla nýrnabilun (kreatínín úthreinsun 30-60 ml / mín., Að meðaltali um það bil 50 ml / mín.), Var sýnt fram á að skammtaaðlögun er ekki nauðsynleg hjá sjúklingum með skerta nýrnastarfsemi. Telmisartan skilst ekki út við blóðskilun. Hjá sjúklingum með skerta nýrnastarfsemi minnkar brotthvarfshýdróklórtíazíð.
Í rannsókn á sjúklingum með meðalúthreinsun kreatíníns 90 ml / mín. Var helmingunartími hýdróklórtíazíðs aukinn. Hjá sjúklingum með nýru sem ekki er starfandi er helmingunartími brotthvarfs um það bil 34 klukkustundir.
Sjúklingar með lifrarbilun
Hjá sjúklingum með lifrarbilun er aukning á aðgengi í 100%. Helmingunartíminn breytist ekki með lifrarbilun.
Lyfhrif
MIKARDIS Plus er sambland af angíótensín II viðtakablokki - telmisartan og þvagræsilyf af tíazíði - hýdróklórtíazíði. Samsetning þessara efnisþátta veitir hærra stig blóðþrýstingslækkandi áhrif en að taka hverja íhluta sérstaklega. Móttaka MIKARDIS Plus einu sinni á dag í meðferðarskömmtum gefur árangursríka og slétta lækkun á blóðþrýstingi.
Telmisartan: Það er áhrifaríkur og sértækur (sértækur) angíótensín II viðtakablokki (gerð AT1). Telmisartan með mjög mikla sækni myndar einungis tengsl við AT1 undirtegundina, angíótensín II viðtaka. Telmisartan hefur ekki skyldleika við aðra viðtaka, þar með talið AT2 - angíótensínviðtaka og aðra, minna rannsakaða, AT viðtaka. Hagnýtur mikilvægi þessara viðtaka, svo og áhrif hugsanlegrar örvunar þeirra með angíótensíni II, sem styrkur þeirra eykst við skipun telmisartans, hefur ekki verið rannsökuð.
Telmisartan leiðir til lækkunar á aldósterónmagni í blóði. Telmisartan hindrar ekki renín í plasma manna og hindrar ekki jónagöng. Telmisartan hindrar ekki virkni angíótensínbreytandi ensíms (kínasa II), en þátttaka þess minnkar á myndun bradykinins. Þess vegna er engin aukning á aukaverkunum af völdum bradykinins.
Hjá sjúklingum blokkar telmisartan í 80 mg skammti næstum fullkomlega háþrýstingsáhrifum angiotensin II. Hömlunaráhrifin eru viðvarandi í 24 klukkustundir og eru enn marktæk í allt að 48 klukkustundir.
Eftir að hafa tekið fyrsta skammtinn af telmisartani verður blóðþrýstingslækkandi áhrif smám saman innan 3 klukkustunda. Hámarks lækkun á blóðþrýstingi næst smám saman 4 vikum eftir upphaf meðferðar og er haldið í langan tíma.
Hjá sjúklingum með háþrýsting lækkar telmisartan slagbils og þanbilsþrýsting án þess að breyta hjartsláttartíðni.
Blóðþrýstingslækkandi verkun telmisartans er sambærileg við aðra flokka blóðþrýstingslækkandi lyfja (eins og sýnt var í klínískum rannsóknum þar sem telmisartan var borið saman við amlodipin, atenolol, enalapril, hýdróklórtíazíð, lósartan, lisinopril, ramipril og valsartan).
Ef um er að ræða skyndilega niðurfellingu telmisartans fer blóðþrýstingur smám saman í gildi fyrir meðferð í nokkra daga án þess að merki séu um hratt aftur háþrýsting (það er ekkert „fráhvarfsheilkenni“).
Í klínískum rannsóknum með beinum samanburði á tveimur tegundum blóðþrýstingslækkandi meðferðar var tíðni þurr hósta hjá sjúklingum sem tóku telmisartan marktækt lægri en hjá þeim sem fengu angíótensínbreytandi ensímhemla.
Hýdróklórtíazíð: er tíazíð þvagræsilyf. Verkunarháttur blóðþrýstingslækkandi áhrifa tíazíð þvagræsilyfja er ekki að fullu þekktur. Tíazíð verkar á nýrnapípulaga verkun rafsöltauppsogs og eykur útskilnað natríums og klóríðs í u.þ.b. jafngóðu magni. Þvagræsandi áhrif hýdróklórtíazíðs draga úr magni í plasma, eykur virkni reníns í plasma, eykur seytingu aldósteróns og síðan aukið tap á kalíum og bíkarbónati í þvagi og minnkun kalíums í sermi. Væntanlega lokun á lokun á renín-angíótensín-aldósterónkerfinu þegar telmisartan er sameinuð hefur tilhneigingu til að snúast við kalíumtapi sem tengist þessum þvagræsilyfjum.
Við töku hýdróklórtíazíðs kemur fram aukning á þvagræsingu eftir 2 klukkustundir, hámarksáhrif koma fram eftir um það bil 4 klukkustundir, meðan verkunartíminn er um 6-12 klukkustundir.
Faraldsfræðilegar rannsóknir hafa sýnt að langvarandi meðferð með hýdróklórtíazíði dregur úr hættu á hjarta- og æðasjúkdómum og dánartíðni vegna þeirra.
Skammtar og lyfjagjöf
MIKARDIS Plus er tekið einu sinni á dag með smá vatni.
Þegar skipt er frá telmisartan yfir í MIKARDIS Plus er hægt að auka skammtinn af telmisartan tímabundið. Bein umskipti frá einlyfjameðferð til að taka samsett lyf eru möguleg.
MIKARDIS Plus 80 mg / 12,5 mg má ávísa sjúklingum þar sem notkun telmisartans (MIKARDIS) 80 mg jafnvægir ekki blóðþrýsting.
MIKARDIS Plus 80 mg / 25 mg má ávísa sjúklingum þar sem notkun MIKARDIS Plus 80 mg / 12,5 mg jafnvægir hvorki blóðþrýsting né sjúklingum þar sem ástand hefur áður verið stöðugt með telmisartan eða hýdróklórtíazíði þegar það er notað sérstaklega.
Hámarks blóðþrýstingslækkandi áhrif næst venjulega innan 4-8 vikna eftir upphaf meðferðar.
Ef nauðsyn krefur er hægt að nota MIKARDIS Plus með öðrum blóðþrýstingslækkandi lyfjum.
Hjá sjúklingum með alvarlegan slagæðaháþrýsting, telmisartan í skömmtum allt að 160 mg á dag (tvö hylki af MIKARDIS 80 mg) eða í samsettri meðferð með hýdróklórtíazíði 12,5-25 mg á dag (tvö hylki af MIKARDIS Plus 80 mg / 12,5 mg eða 80 mg / 25 mg) var vel þolað og áhrifaríkt.
MIKARDIS Plus má taka óháð fæðuinntöku.
Vegna nærveru MIKARDIS Plus hýdróklórtíazíðs í blöndunni á ekki að ávísa sjúklingum með verulega nýrnabilun (kreatínín úthreinsun