Lyfið Zaltrap: notkunarleiðbeiningar
Verslunarheiti lyfsins: Zaltrap
Alþjóðlegt heiti sem ekki er fjárnám: Aflibercept
Skammtaform: innrennslislausnarþykkni
Virkt efni: aflibercept
Flokkun eftir verkun: andstæðingur-æxli
Lyfjafræðilegir eiginleikar:
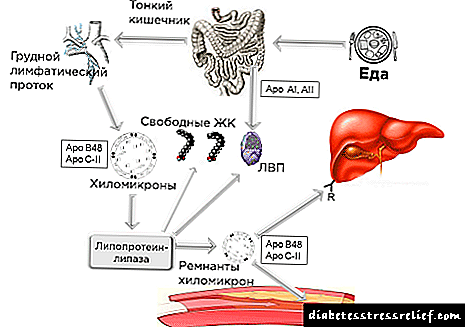
Andoxunarlyf. Aflibercept er raðbrigða samrunaprótein sem samanstendur af VEGF (æðaþels vaxtarstuðull) sem bindur hluta utanfrumugreina VEGF 1 viðtakans og VEGF 2 viðtakans sem eru tengdir við FS lénið (brot úr kristallað broti) af ónæmisglóbúlíni G1 úr mönnum (IgG1). Aflibercept er framleitt með raðbrigða DNA tækni með því að nota kínverska eggjastokkafrumukerfið (CHO) K-1. Aflibercept er chimeric glycoprotein með mólmassa 97 kDa, prótein glýkósýlering bætir 15% við heildar mólmassa, sem leiðir til heildar mólmassa aflibercept af 115 kDa. Æðaþels vaxtarstuðull A (VEGF-A), æðaþels vaxtarstuðull B (VEGF-B) og vaxtarþáttur fylgju (P1GF) tilheyra VEGF-fjölskyldu æðamyndunarþátta sem geta virkað sem sterkur hvatberi, lyfjameðferð og gegndræpi sem hefur áhrif á æða. fyrir æðaþelsfrumur. VEGF-A verkar í gegnum tvo viðtaka týrósín kínasa - VEGFR-1 og VEGFR-2, staðsett á yfirborði æðaþelsfrumna. P1GF og VEGF-B bindast aðeins VEGFR-1 viðtakanum týrósín kínasa, sem, auk nærveru á yfirborði æðaþelsfrumna, er einnig staðsett á yfirborði hvítkorna. Óhófleg virkjun þessara VEGF-A viðtaka getur leitt til meinafræðilegrar æðaæðar og aukinnar gegndræpi í æðum. P1GF er einnig tengt þróun meinafræðilegra nýrnaæxla og síast í æxli með bólgufrumum. Aflibercept virkar sem leysanleg „viðtakagildra“ sem binst VEGF-A með meiri sækni en innfæddir VEGF-A viðtakar, auk þess sem það binst einnig skyldum bindlum VEGF-B og P1GF. Aflibercept binst VEGF-A, VEGF-B og P1GF úr mönnum með myndun stöðugra óvirkra fléttna sem hafa ekki líffræðilega virkni. Starfar sem „gildra“ fyrir bindla, kemur aflibercept í veg fyrir bindingu innrænna bindla við viðtaka þeirra og hindrar þannig merki í gegnum þessa viðtaka. Aflibercept hindrar virkjun VEGF viðtaka og útbreiðslu æðaþelsfrumna og hindrar þannig myndun nýrra skipa sem gefa æxlinu súrefni og næringarefni. Aflibercept binst VEGF-A úr mönnum (jafnvægisskiljunarfasti (Cd) er 0,5 pmól fyrir VEGF-A165 og 0,36 pmól fyrir VEGF-A121), P1GF manna (Cd 39 pmól til P1GF-2), við VEGF-B (Cd) 1,92 pmól) með myndun stöðugs óvirks fléttu sem hefur ekki skilgreina líffræðilega virkni.
Ábendingar til notkunar:
Krabbamein í ristli og endaþarmi (MKRP) (hjá fullorðnum sjúklingum) sem er ónæm fyrir krabbameinslyfjameðferð sem inniheldur oxalíplatín eða gengur eftir notkun þess (Zaltrap í samsettri meðferð með irinotecan, flúoróúrasíli, kalsíumfolinati (FOLFIRI)).
Frábendingar:
Ofnæmi fyrir aflibercept eða einhverju hjálparefnanna Zaltrap, alvarlegar blæðingar, slagæðarháþrýstingur, lyfjaónæmir, langvarandi hjartabilun í III-IV flokki (NYHA flokkun), alvarleg lifrarbilun (skortur á gögnum til notkunar), notkun í auga eða kynning á gláru líkamanum (vegna oförvandi einkenna lyfsins Zaltrap), meðgöngu, brjóstagjöf, börnum og unglingum AST 18 ára (vegna skorts á nægilega reynslu af beitingu).Varúðarráðstafanir: alvarlegur nýrnabilun, slagæðarháþrýstingur, klínískt marktækir sjúkdómar í hjarta- og æðakerfi (CHD, langvarandi hjartabilun flokkur I-II samkvæmt NYHA flokkun), háþróaður aldur, almennt ástand ≥ 2 stig á kvarðanum til að meta almennt ástand sjúklings ECOG ( Sameiginlegur hópur krabbameinslækninga í Austurlöndum).
Skammtar og lyfjagjöf:
Zaltrap er gefið í bláæð í innrennsli í 1 klukkustund, á eftir notkun lyfjameðferðarmeðferðarinnar FOLFIRI. Ráðlagður skammtur af Zaltrap í samsettri meðferð með lyfjameðferðinni FOLFIRI er 4 mg / kg líkamsþunga. FOLFIRI lyfjameðferð: fyrsta daginn í lotunni - samtímis innrennsli í bláæð í gegnum Y-laga irinotecan legg í 180 mg / m2 skammti í 90 mínútur og kalsíumfolinat (vinstri og hægri hönd racemates) í 400 mg / m2 skammti í 2 klukkustundir , fylgt eftir með iv (bolus) gjöf flúoróúrasíls í 400 mg / m2 skammti, fylgt eftir með stöðugu innrennsli flúoróúrasíls í bláæð í 2400 mg / m2 í 46 klukkustundir. Lyfjameðferðarlotur eru endurteknar á tveggja vikna fresti. Halda ætti meðferð með Zaltrap áfram þar til sjúkdómurinn líður á eftir eða óásættanleg eituráhrif þróast.
Aukaverkanir:
Algengustu aukaverkanirnar (HP) sem komu fram í öllum alvarleikastigum (með tíðni ≥20%) eru að minnsta kosti 2% algengari með Zaltrap / FOLFIRI lyfjameðferð en með FOLFIRI lyfjameðferð (í minnkandi röð atviks): hvítfrumnafæð, niðurgangur, daufkyrningafæð, próteinmigu, aukin virkni ACT, munnbólga, þreyta, blóðflagnafæð, aukin ALT virkni, aukinn blóðþrýstingur, minnkuð líkamsþyngd, minnkuð matarlyst, nefblæðingar, kviðverkir, meltingartruflanir, aukinn styrk kreatínín í sermi og höfuðverkur. Oftast sást eftirfarandi HPs með 3-4 alvarleika (með tíðni ≥5%), að minnsta kosti 2% oftar með Zaltrap / FOLFIRI lyfjameðferð en með FOLFIRI lyfjameðferðaráætlun (í röð til minnkandi tíðni): daufkyrningafæð, niðurgangur, hækkaður blóðþrýstingur, hvítfrumnafæð, munnbólga, þreyta, próteinmigu og þróttleysi. Almennt sást að meðferð var hætt vegna aukaverkana (af öllum alvarleikastigum) hjá 26,8% sjúklinga sem fengu Zaltrap / FOLFIRI lyfjameðferð, samanborið við 12,1% sjúklinga sem fengu FOLFIRI lyfjameðferð. Algengustu HP-lyfin sem ollu höfnun meðferðar hjá ≥1% sjúklinga sem fengu Zaltrap / FOLFIRI lyfjameðferðaráætlun voru þróttleysi / þreyta, sýkingar, niðurgangur, ofþornun, hækkaður blóðþrýstingur, munnbólga, bláæðasegarek, fylgikvillar, daufkyrningafæð og próteinmigu. Skammtaaðlögun lyfsins Zaltrap (minnkun skammta og / eða aðgerðaleysi) var framkvæmd í 16,7%. Frestun síðari meðferðarlotna yfir 7 daga sást hjá 59,7% sjúklinga sem fengu Zaltrap / FOLFIRI lyfjameðferð, samanborið við 42,6% sjúklinga sem fengu FOLFIRI lyfjameðferð. Dauði af öðrum orsökum, öðrum en dauða vegna versnunar sjúkdóms, sem kom fram innan 30 daga frá því að síðasta lota lyfjameðferðarmeðferðar var rannsökuð hjá 2,6% sjúklinga sem fengu Zaltrap / FOLFIRI lyfjameðferð og hjá 1,0% sjúklinga sem fengu FOLFIRI lyfjameðferð. Dánarorsök hjá sjúklingum sem fengu Zaltrap / FOLFIRI krabbameinslyfjameðferð var sýking (þ.mt daufkyrningafæð) hjá 4 sjúklingum, ofþornun hjá 2 sjúklingum, blóðþurrð í 1 sjúklingi, umbrotsheilakvilli hjá 1 sjúklingi, öndunarfærasjúkdómur (bráður öndunarfærasjúkdómur, aspiration lungnabólga og segarek í lungum) hjá 3 sjúklingum, sár í meltingarvegi (blæðing frá skeifugarnarsár, bólga í meltingarvegi, fullkomin teppu í þörmum) hjá 3 sjúklingum, dauði frá óþekktum sjúklingum Ná til 2 sjúklinga.Hér á eftir koma fram frávik frá HP og rannsóknarstofum sem komu fram hjá sjúklingum sem fengu meðferð með Zaltrap / FOLFIRI lyfjameðferð. Upplýsingar um HP voru skilgreindar sem óæskileg klínísk viðbrögð eða frávik í rannsóknarstofubreytum, en tíðni þeirra var ≥ 2% hærri (fyrir HP af öllum alvarleikastigum) hjá aflibercept hópnum samanborið við lyfleysuhópinn í rannsókn sem gerð var á sjúklingum með ICP. HP styrkleiki var flokkaður samkvæmt NCI CTC (National Cancer Institute General Toxicity Rating Scale) útgáfu 3.0. Að ákvarða tíðni HP (samkvæmt WHO flokkuninni): mjög oft (≥10%), oft (≥1% - 3 stig af alvarleika), oft þróttleysi (≥3 stig af alvarleika), sjaldan - skert sár gróa (frávik sárbrúna , bilun anastomoses) (öll stig af alvarleika og ≥ 3 stig af alvarleika).
Upplýsingar um rannsóknarstofu og tæki: mjög oft - aukin virkni ACT, ALT (öll stig af alvarleika), minnkuð líkamsþyngd (öll stig alvarleika), oft - aukin virkni ACT, ALT ≥3 stig af alvarleika, lækkuð líkamsþyngd ≥3 stig af alvarleika.
Milliverkanir við önnur lyf:
Formlegar rannsóknir á milliverkunum við Zaltrap hafa ekki verið gerðar. Í samanburðarrannsóknum var styrkur frjálsrar og bundins aflibercept ásamt öðrum lyfjum svipaður og einlyfjameðferðar, sem bendir til þess að þessar samsetningar (oxaliplatin, cisplatin, fluorouracil, irinotecan, docetaxel, pemetrexed, gemcitabin og erlotinib) hafi ekki áhrif á lyfjahvörf aflibercepta. Aflibercept hafði aftur á móti ekki áhrif á lyfjahvörf irinotecans, fluorouracil, oxaliplatin, cisplatin, docetaxel, pemetrexed, gemcitabin og erlotinib.
Gildistími: 3 ár
Orlofskjör lyfjafræði: eftir lyfseðli
Frábendingar
- Ofnæmi fyrir aflibercept eða einhverju hjálparefnanna.
- slagæðarháþrýstingur, ekki læknisfræðileg leiðrétting,
- langvarandi hjartabilun III-IV flokkur (NYHA flokkun),
- alvarleg lifrarbilun (skortur á upplýsingum um notkun),
- notkun í auga eða lyfjagjöf í glasarlíkamanum (vegna oförvandi eiginleika lyfsins),
- brjóstagjöf,
- börn og unglingar yngri en 18 ára (vegna skorts á fullnægjandi reynslu af notkun).
alvarleg nýrnabilun,
- klínískt marktækir sjúkdómar í hjarta- og æðakerfi (kransæðahjartasjúkdómur, langvarandi I-II flokkur samkvæmt NYHA flokkun),
- Almennt ástand> 2 stig á kvarðanum til að meta almennt ástand sjúklings ECOG (Eastern United Group krabbameinslækna).
Hvernig á að nota: skammta og meðferðar
Innrennsli í bláæð sem innrennsli í 1 klukkustund, á eftir notkun lyfjameðferðarmeðferðarinnar FOLFIRI.
Ráðlagður skammtur, ásamt FOLFIRI lyfjameðferð, er 4 mg / kg líkamsþunga.
Lyfjameðferðarkerfi FOLFIRI:
á fyrsta degi lotunnar - samtímis innrennsli í bláæð í gegnum Y-laga legginn af irinotecan í skammtinum 180 mg / m2 í 90 mínútur og kalsíumfolínat (vinstri og hægri hönd racemates) í 400 mg / m2 skammti í 2 klukkustundir, fylgt eftir í bláæð (bolus) ) innleiðing flúoróúrasíls í 400 mg / m2 skammti, fylgt eftir með stöðugu innrennsli flúoróúrasíls í 2400 mg / m2 skammti í 46 klukkustundir.
Lyfjameðferðarlotur eru endurteknar á tveggja vikna fresti.
Halda skal meðferð áfram þar til versnun sjúkdóms eða óásættanleg eituráhrif þróast.
Ráðleggingar um leiðréttingu á skammtaáætlun / seinkun meðferðar
Hætta skal meðferð:
- með þróun alvarlegra blæðinga,
- með þróun götunar á veggjum meltingarvegsins,
- með myndun fistils,
- með þróun háþrýstingskreppu eða heilakvilla í háþrýstingi,
- með þróun segamyndunar fylgikvilla í slagæðum,
- með þróun nýrungaheilkenni eða segamyndun í æðamyndun,
- með alvarlegum ofnæmisviðbrögðum (þ.mt berkjukrampa, mæði, ofsabjúgur, bráðaofnæmi),
- í bága við sáraheilun sem krefst læknisaðgerða,
- með þróun afturkræfs posterior heilakvillaheilkennis (POPs), einnig þekktur sem afturkræfur bakkakvöðvakvilli (POP).
Að minnsta kosti 4 vikum fyrir áætlaða aðgerð ætti að stöðva meðferð með Zaltrap tímabundið.
Seinkun lyfjameðferðar Zaltrap / FOLFIRI
Daufkyrningafæð eða blóðflagnafæð: Fresta skal notkun Zaltrap / FOLFIRI lyfjameðferðar þar til fjöldi daufkyrninga í útlæga blóði eykst í> 1500 / μl og / eða fjöldi blóðflagna í útlæga blóði eykst í> 75000 / μl.
Væg eða í meðallagi ofnæmisviðbrögð (þ.mt roði í húð, útbrot, ofsakláði og kláði): Hætta skal meðferð tímabundið þar til viðbrögðin hætta. Ef nauðsyn krefur, til að stöðva ofnæmisviðbrögðin, er mögulegt að nota GCS og / eða andhistamín.
Í síðari lotum geturðu haft í huga forvígingu GCS og / eða andhistamína.
Alvarleg ofnæmisviðbrögð (þ.mt berkjukrampar, mæði, ofsabjúgur og bráðaofnæmi): Hætta ætti lyfjameðferð með Zaltrap / FOLFIRI og hætta meðferð sem miðar að því að stöðva ofnæmisviðbrögðin.
Frestun meðferðar með Zaltrap og skammtaaðlögun
Hækkun blóðþrýstings: Þú ættir að hætta notkun lyfsins tímabundið þar til þú ná stjórn á hækkun blóðþrýstings.
Með endurtekinni þróun verulegs hækkunar á blóðþrýstingi ætti að stöðva notkun lyfsins þar til stjórn á hækkun blóðþrýstings næst og í síðari lotum minnka skammtinn í 2 mg / kg líkamsþunga.
Próteinmigu: Nauðsynlegt er að stöðva notkun lyfsins við próteinmigu> 2 g / dag, endurtekning meðferðar er möguleg eftir að próteinmigu hefur verið lækkað í 2 g / dag; stöðva ætti notkun Zaltrap þar til próteinmigu minnkar 20%), að minnsta kosti 2% oftar þegar krabbameinslyfjameðferð Zaltrap er notuð / FOLFIRI en með FOLFIRI lyfjameðferðaráætluninni (í fækkandi tilvikum): hvítfrumnafæð, niðurgangur, daufkyrningafæð, próteinmigu, aukin verkun á verkun, munnbólga, þreyta, blóðflagnafæð, aukin virkni ALT, hækkaður blóðþrýstingur, þyngdartap, minnkuð matarlyst, blóðnasir, kviðverkir, raddtruflun, hækkað kreatínín þéttni og höfuðverkur í sermi.
Eftirfarandi HPs með 3-4 alvarleika sáust oftast (með tíðni> 5%), að minnsta kosti 2% oftar þegar Zaltrap / FOLFIRI lyfjameðferð var notuð en þegar FOLFIRI lyfjameðferð var notuð (til að draga úr tíðni): daufkyrningafæð, niðurgangur, hækkaður blóðþrýstingur, hvítfrumnafæð, munnbólga, þreyta, próteinmigu og þróttleysi.
Almennt sást að meðferð var hætt vegna aukaverkana (af öllum alvarleikastigum) hjá 26,8% sjúklinga sem fengu Zaltrap / FOLFIRI lyfjameðferð, samanborið við 12,1% sjúklinga sem fengu FOLFIRI lyfjameðferð.
Algengustu aukaverkanirnar sem olli því að meðferð var hætt hjá> 1% sjúklinga sem fengu Zaltrap / FOLFIRI lyfjameðferð, voru þróttleysi / þreyta, sýkingar, niðurgangur, ofþornun, hækkaður blóðþrýstingur, munnbólga, bláæðasegarek, fylgikvillar, daufkyrningafæð og próteinmigu.
Skammtaaðlögun (skammtaminnkun og / eða aðgerðaleysi) var framkvæmd hjá 16,7%. Frestun síðari meðferðarlotna yfir 7 daga sást hjá 59,7% sjúklinga sem fengu Zaltrap / FOLFIRI lyfjameðferð, samanborið við 42,6% sjúklinga sem fengu FOLFIRI lyfjameðferð.
Dauði af öðrum orsökum, öðrum en dauða vegna versnunar sjúkdóms, sem kom fram innan 30 daga frá því að síðasta lota lyfjameðferðarmeðferðar var rannsökuð hjá 2,6% sjúklinga sem fengu Zaltrap / FOLFIRI lyfjameðferð og hjá 1,0% sjúklinga sem fengu FOLFIRI lyfjameðferð. Dánarorsök hjá sjúklingum sem fengu Zaltrap / FOLFIRI krabbameinslyfjameðferð var sýking (þ.mt daufkyrningafæð) hjá 4 sjúklingum, ofþornun hjá 2 sjúklingum, blóðþurrð í 1 sjúklingi, umbrotsheilakvilli hjá 1 sjúklingi, öndunarfærasjúkdómur (bráður öndunarbilun, öndunarbólga) og lungnasegarek) hjá 3 sjúklingum, meltingarfærum (blæðingar frá skeifugarnarsár, bólga í meltingarvegi, fullkomin þörmun í þörmum) hjá 3 sjúklingum, banvæn niðurstaða vegna óþekktar augljósar ástæður hjá 2 sjúklingum.
Hér á eftir koma fram frávik frá HP og rannsóknarstofum sem komu fram hjá sjúklingum sem fengu meðferð með Zaltrap / FOLFIRI lyfjameðferð. Upplýsingar um HP voru skilgreindar sem óæskileg klínísk viðbrögð eða frávik í rannsóknarstofubreytum, en tíðni þeirra var> 2% hærri (fyrir HP af öllum alvarleikastigum) hjá aflibercept hópnum samanborið við lyfleysuhópinn í rannsókn sem gerð var á sjúklingum með ICP. HP styrkleiki var flokkaður samkvæmt NCI CTC (National Cancer Institute General Toxicity Rating Scale) útgáfu 3.0.
Ákvörðun á tíðni HP (samkvæmt WHO flokkuninni): mjög oft (> 10%), oft (> 1% - 0,1% - 0,01% - 3 stig af alvarleika).
Úr blóði og eitlum: mjög oft - hvítfrumnafæð (öll stig af alvarleika og> 3 stig af alvarleika), daufkyrningafæð (öll stig af alvarleika og> 3 stig af alvarleika), blóðflagnafæð (öll stig af alvarleika), oft - daufkyrningafæð með hita í öllum alvarleika og> 3 stig af alvarleika, blóðflagnafæð> 3 stig af alvarleika.
Af hálfu ónæmiskerfisins: oft - ofnæmisviðbrögð (öll stig af alvarleika), sjaldan - Ofnæmisviðbrögð> 3 stig af alvarleika.
Frá hlið efnaskipta og næringar: mjög oft - minnkuð matarlyst (öll stig af alvarleika), oft - ofþornun (öll alvarleika og> 3 stig af alvarleika), lystarleysi> 3 stig af alvarleika.
Frá hlið taugakerfisins: mjög oft - höfuðverkur (af öllum alvarleikastigum), oft - höfuðverkur> 3 stig af alvarleika, sjaldan - afturkræft bakheilakvillaheilkenni (SARS).
Frá hjarta- og æðakerfi: mjög oft - hækkaður blóðþrýstingur (af öllum stigum alvarleika) (hjá 54% sjúklinga sem voru með hækkun á blóðþrýstingi> 3 stig af alvarleika, hækkun á blóðþrýstingi þróaðist í fyrstu tveimur meðferðarlotunum), blæðingar / blæðingar (allar gráður) alvarleiki), algengasta tegund blæðinga er minniháttar blæðingar í nefi (1-2 stigs alvarleiki), oft fylgikvillar í segarek í slagæðum (ATEO) (svo sem bráðir heilaæðasjúkdómar, þar með talin tímabundin blóðþurrð í heilaæðum, hjartaöng, segamyndun í hjarta, hjartadrep, segarek í slagæðum og blóðþurrð í blóðþurrð (öll alvarleg stig), bláæðasegareks fylgikvillar (VTEO) (segamyndun í æðum og lungnasegarek) af öllum stigum alvarleika, blæðingar> 3 ára alvarleiki, með alvarleika 3 ára, þ.mt blæðingar í meltingarvegi, blóðmigu, blæðingar eftir læknisaðgerðir, óþekkt tíðni - hjá sjúklingum sem fengu Zaltrap var greint frá þróun alvarlegrar blæðingar innan höfuðkúpu og lungnablæðingar. ný / blóðskilun, þar með talin banvæn útkoma.
Frá öndunarfærum: Mjög oft - mæði (af öllum alvarleikastigum), nefblæðingar (af öllum alvarleikastigum), meltingartruflanir (af öllum alvarleikastigum), oft - verkir í meltingarvegi (allar gráður af alvarleika), nefslímur (aðeins 1-2 nefslímur sáust alvarleiki), sjaldan - mæði> 3 stig af alvarleika, blæðingar í nefi> 3 stig af alvarleika, meltingartruflanir> 3 stig af alvarleika, verkir í meltingarvegi> 3 stig af alvarleika.
Frá meltingarfærum: Mjög oft - niðurgangur (öll stig af alvarleika og> 3 stig af alvarleika), munnbólga (öll stig af alvarleika og> 3 stig af alvarleika), kviðverkir (allir gráður af alvarleika), verkir í efri hluta kviðarhols (allar gráður af alvarleika) , oft - kviðverkir> 3 stig af alvarleika, verkur í efri hluta kviðarhols> 3 stig af alvarleika, gyllinæð (öll stig af alvarleika), blæðing frá endaþarmi (öll stig af alvarleika), verkur í endaþarmi (öll stig alvarleika), tannverkur ( allar gráður af alvarleika), aphthous munnbólga (allar gráður af alvarleika) borða) myndun fistúla (endaþarms, smáþarmi, þvaglát, smáþörmum smáhúð, ristli-leggöngum, milligöngum) (öll stig af alvarleika), sjaldan - myndun fistúlna í meltingarvegi> 3 stig af alvarleika, rof á veggjum meltingarvegsins í öllum gráðum og 3 stig af alvarleika, þ.mt banvæn göt á veggjum meltingarvegar, blæðingar frá endaþarmi> 3 stig af alvarleika, aphthous munnbólga> 3 stig af alvarleika, verkur í endaþarmi> 3 stig af alvarleika.
Frá húð og undirhúð: mjög oft - lófa-plantar rauðkornaheilkenni heilkenni (öll stig alvarleika), oft - oflitun húðar (öll stig af alvarleika), lóði-plantar rauðkornaheilkenni heilkenni> 3 stig af alvarleika.
Úr þvagfærakerfinu: mjög oft - próteinmigu (samkvæmt samsettum klínískum rannsóknum og rannsóknarstofuupplýsingum) (öll alvarleg stig), aukning á styrk sermis kreatíníns (öll stig af alvarleika), oft - próteinmigu> 3 stig af alvarleika, sjaldan - nýrungaheilkenni. Einn sjúklingur með próteinmigu og hækkaði blóðþrýsting hjá 611 sjúklingum sem fengu meðferð með Zaltrap / FOLFIRI lyfjameðferð, var greindur með segamyndun í æðamyndun.
Almenn viðbrögð: mjög oft - þróttleysi (öll alvarleiki), þreytutilfinning (öll alvarleika og> 3 stig), oft - þróttleysi (> 3 stig af alvarleika), sjaldan - skert sár gróa (frávik í jöðrum sársins, bilun anastomoses ) (allar gráður af alvarleika og> 3 stig af alvarleika).
Upplýsingar um rannsóknarstofu og tæki: mjög oft - aukin virkni ACT, ALT (öll stig af alvarleika), minnkuð líkamsþyngd (öll stig alvarleika), oft - aukin virkni ACT, ALT> 3 stig af alvarleika, þyngdartap> 3 stig af alvarleika.
Tíðni aukaverkana hjá sérstökum sjúklingahópum
Hjá öldruðum sjúklingum (> 65 ára) var tíðni niðurgangs, svima, þróttleysis, þyngdartaps og ofþornunar meira en 5% hærri en hjá sjúklingum á yngri aldri. Fylgjast skal náið með öldruðum sjúklingum með tilliti til niðurgangs og / eða hugsanlegrar ofþornunar.
Hjá sjúklingum með væga skerðingu á nýrnastarfsemi þegar byrjað var að nota lyfið, var tíðni HP sambærileg og hjá sjúklingum án skertrar nýrnastarfsemi á þeim tíma sem byrjað var. Hjá sjúklingum með miðlungsmikla og verulega skerta nýrnastarfsemi var tíðni HP utan nýrna almennt sambærileg og hjá sjúklingum án nýrnabilunar, að undanskildum aukningu á ofþornun (af öllum stigum alvarleika) um> 10%.
Eins og öll önnur próteinlyf, hefur aflibercept hugsanlega hættu á ónæmingargetu. Almennt, samkvæmt niðurstöðum allra klínískra rannsókna á krabbameinslækningum, sýndi enginn sjúklinganna mikla títra af mótefnum gegn aflibercept.
Engar upplýsingar liggja fyrir um öryggi þess að taka Zaltrap í skömmtum sem eru stærri en 7 mg / kg einu sinni á tveggja vikna fresti eða 9 mg / kg einu sinni á þriggja vikna fresti. Algengasta HP sem sést hefur með þessum skömmtum var svipað og HP sem kom fram við notkun lyfsins í meðferðarskömmtum.
Það er ekkert sérstakt mótefni gegn lyfinu.Við ofskömmtun þurfa sjúklingar stuðningsmeðferð, einkum eftirlit og meðferð á slagæðarháþrýstingi og próteinmigu. Fylgjast skal náið með sjúklingnum til að bera kennsl á og hafa eftirlit með HP.
Sérstakar leiðbeiningar
Áður en meðferð hefst og áður en byrjað er á hverri nýrri meðferðarlotu með aflibercept er mælt með því að framkvæma almenna blóðrannsókn með skilgreiningu á hvítfrumnaformúlu.
Með fyrstu þróun daufkyrningafæðar> 3 stigs alvarleika, ætti að íhuga meðferðarnotkun G-CSF, auk þess hjá sjúklingum sem eru í aukinni hættu á að fá daufkyrningafræðilega fylgikvilla, er mælt með því að taka upp G-CSF til að koma í veg fyrir daufkyrningafæð.
Fylgjast skal stöðugt með sjúklingum með tilliti til einkenna meltingarfæra og annarra alvarlegra blæðinga. Aflibercept á ekki að gefa sjúklingum með alvarlegar blæðingar.
Fylgjast skal með sjúklingum með tilliti til merkja og einkenna götunar á veggjum meltingarvegsins. Ef um er að ræða götun á veggjum meltingarvegsins, skal hætta meðferð með aflibercept.
Með því að þróa fistúlur, ætti að hætta meðferð með aflibercept.
Meðan á meðferð með aflibercept stendur er mælt með að fylgjast með blóðþrýstingi á tveggja vikna fresti, þ.mt að fylgjast með blóðþrýstingi áður en aflibercept er gefið, eða oftar samkvæmt klínískum ábendingum meðan á aflibercept meðferð stendur. Ef um er að ræða aukinn blóðþrýsting meðan á meðferð með aflibercept stendur, skal nota viðeigandi blóðþrýstingslækkandi meðferð og fylgjast reglulega með blóðþrýstingi. Með of mikilli hækkun á blóðþrýstingi ætti að stöðva meðferð með aflibercept þar til blóðþrýstingur lækkar niður í markgildin og í síðari lotum ætti að minnka skammt af aflibercept í 2 mg / kg. Ef um er að ræða háþrýstingskreppu eða heilakvilla vegna háþrýstings, skal hætta notkun lyfsins aflibercept.
Gæta skal varúðar þegar Zaltrap er gefið sjúklingum með klínískt áberandi hjarta- og æðasjúkdóm, svo sem kransæðahjartasjúkdóm og hjartabilun. Engar klínískar rannsóknir hafa verið gerðar á lyfjagjöf hjá sjúklingum með hjartabilun í starfi III og IV samkvæmt NYHA flokkun.
Ef sjúklingur þróar ATEO, skal hætta meðferð með aflibercept.
Áður en hver aflibercept er gefið skal ákvarða próteinmigu með vísbendisrönd eða með því að ákvarða hlutfall próteins / kreatíníns í þvagi til að greina þróun eða aukningu próteinmigu. Sjúklingar með hlutfall próteins / kreatíníns í þvagi> 1 ættu að ákvarða magn próteins í daglegu þvagi.
Með þróun nýrungaheilkennis eða segamyndun í æðakerfi, skal hætta meðferð með aflibercept.
Verði alvarleg ofnæmisviðbrögð (þ.mt berkjukrampa, mæði, ofsabjúgur og bráðaofnæmi), skal hætta meðferð og hefja viðeigandi meðferð sem miðar að því að stöðva þessi viðbrögð.
Ef væg ofnæmisviðbrögð við aflibercept myndast (þ.mt ofnæmi í húð, útbrot, ofsakláði, kláði), ætti að stöðva meðferð tímabundið þar til viðbrögðin ganga eftir. Ef það er klínískt nauðsynlegt er hægt að nota barkstera og / eða andhistamín til að stöðva þessi viðbrögð. Í síðari lotum geturðu haft í huga forvígingu GCS og / eða andhistamína. Þegar meðferð er hafin að nýju á sjúklingum sem áður hafa fengið ofnæmisviðbrögð, skal gæta varúðar, vegna þess að hjá sumum sjúklingum kom fram þróun á ofnæmisviðbrögðum, þrátt fyrir fyrirbyggjandi meðferð, þ.mt notkun barkstera.
Hætta skal notkun aflibercept í að minnsta kosti 4 vikur eftir meiriháttar skurðaðgerðir og þar til skurðsár er alveg gróið. Við minniháttar skurðaðgerðir, svo sem uppsetningu miðlægs bláæðaleggs, vefjasýni, útdrátt tanna, er hægt að hefja / hefja meðferð með aflibercept eftir að skurðsár hefur alveg gróið.Hætta skal notkun aflibercept hjá sjúklingum með skerta sáraheilun sem þurfa læknisaðgerðir.
POP-lyf geta komið fram með breytingum á andlegu ástandi, flogaköstum, ógleði, uppköstum, höfuðverkjum og sjóntruflunum. Greining LUTS er staðfest með segulómskoðun í heila. Hætta skal notkun aflibercept hjá sjúklingum með POP-lyf.
Aldraðir sjúklingar (> 65 ára) eru í aukinni hættu á að fá niðurgang, sundl, þróttleysi, þyngdartap og ofþornun. Til að lágmarka áhættuna þurfa slíkir sjúklingar vandlega lækniseftirlit til að greina og meðhöndla einkenni niðurgangs og ofþornunar snemma.
Sjúklingar með almenna ástandsvísitölu> 2 stig (á fimm punkta 0-4 stiga matsskala ECOG í Austur sameiginlega krabbameinslækningahópnum) eða sem eru með alvarlega samhliða sjúkdóma geta verið í meiri hættu á skaðlegum klínískum niðurstöðum og þarfnast vandaðs lækniseftirlits til að greina snemma klíníska rýrnun.
Zaltrap er oförvandi hreyfing, samsetningin er ósamrýmanleg innleiðingunni í augnrýmið. Ekki er hægt að færa lyfið inn í glöskennda líkamann.
Engar rannsóknir hafa verið gerðar á áhrifum Zaltrap á hæfni til aksturs ökutækja eða annarra hættulegra aðgerða. Ef sjúklingar þróa einkenni sem hafa áhrif á sjón þeirra og einbeitingargetu, svo og hægja á geðhvörfum, skal ráðleggja sjúklingum að forðast akstur ökutækja og aðrar hættulegar athafnir.
Meðganga og brjóstagjöf
Engar upplýsingar liggja fyrir um notkun aflibercept á meðgöngu. Í tilraunirannsóknum komu í ljós eituráhrif á fósturvísi og vansköpun aflibercept hjá dýrum. Vegna þess að æðamyndun skiptir miklu máli fyrir þróun fósturvísa; hömlun á æðamyndun við gjöf Zaltrap getur valdið óhagstæðum áhrifum á þungun. Ekki má nota lyfið á meðgöngu.
Ráðleggja ætti konum á barneignaraldri að forðast getnað meðan á meðferð með Zaltrap stendur. Upplýsa skal þau um möguleika á skaðlegum áhrifum lyfsins á fóstrið.
Konur á barneignaraldri og frjósömir karlar ættu að nota öruggar getnaðarvarnir meðan á meðferð stendur og í að minnsta kosti 6 mánuði eftir síðasta skammt lyfsins.
Líkur eru á skertri frjósemi hjá körlum og konum meðan á meðferð með aflibercept stendur (byggt á gögnum sem fengust í rannsóknum sem gerðar voru á öpum, hjá körlum og konum þar sem aflibercept olli frjósemisröskunum, alveg afturkræf eftir 8-18 vikur).
Engar klínískar rannsóknir hafa verið gerðar til að meta áhrif Zaltrap á framleiðslu brjóstamjólkur, einangrun aflibercept með brjóstamjólk og áhrif lyfsins á ungbörn.
Ekki er vitað hvort aflibercept með brjóstamjólk skilst út hjá konum. Vegna þess að það er ómögulegt að útiloka möguleikann á aflibercept skarpskyggni í brjóstamjólk, svo og möguleikann á að fá alvarlegar aukaverkanir sem aflibercept getur valdið ungbörnum, er nauðsynlegt annað hvort að neita að hafa barn á brjósti eða ekki nota Zaltrap ( fer eftir mikilvægi notkunar lyfsins fyrir móðurina).
Samspil
Formlegar rannsóknir á milliverkunum við Zaltrap hafa ekki verið gerðar.
Í samanburðarrannsóknum var styrkur frjálsrar og bundins aflibercept ásamt öðrum lyfjum svipaður og styrkur aflibercepts með einlyfjameðferð, sem bendir til þess að þessar samsetningar (oxaliplatin, cisplatin, fluorouracil, irinotecan, docetaxel, pemetrexed, gemcitabin og erlotinib) hafi ekki áhrif lyfjahvörf aflibercept.
Nosological flokkun (ICD-10)
| Þykkni, innrennslislyf, lausn | 1 ml |
| virkt efni: | |
| aflibercept | 25 mg |
| hjálparefni: natríum tvíhýdrógenfosfat einhýdrat - 0,5774 mg, natríumhýdrógenfosfat heptahýdrat - 0,2188 mg, sítrónusýrueinhýdrat - 0,0443 mg, natríumsítrat tvíhýdrat - 1,4088 mg, natríumklóríð - 5,84 mg, 0,1 M saltsýralausn sýru eða 0,1 M natríumhýdroxíðlausn - allt að pH 5,9-6,5, súkrósa - 200 mg, pólýsorbat 20 - 1 mg, vatn fyrir stungulyf - allt að 1 ml |
Lyfhrif
Aflibercept er raðbrigða samrunaprótein sem samanstendur af því að bindast VEGF (vaxtarþáttur æðaþelsæðaþels vaxtarþættir) hlutar utanfrumuviðtakanna VEGF-1 og VEGF-2 tengdur við Fc lénið (brot sem geta kristallað) IgG1 manneskja.
Aflibercept er framleitt með raðbrigða DNA tækni með því að nota kínverska eggjastokkafrumukerfið (CHO) K-1.
Aflibercept er chimeric glycoprotein með mólmassa 97 kDa, prótein glýkósýlering bætir 15% við heildar mólmassa, sem leiðir til heildar mólmassa aflibercept af 115 kDa.
Æðaþels vaxtarþáttur A (VEGF-A), æðaþels vaxtarþáttur B (VEGF-B) og vaxtarþáttur fylgju (PLGF) tengjast VEGF- fjölskylda af æðamyndandi þáttum sem geta virkað sem sterkir mítógen-, lyfjameðferðar- og æðastærðir fyrir æðaþelsfrumur. Aðgerð VEGF-A framkvæmt í gegnum tvo viðtaka týrósín kínasa - VEGFR-1 og VEGFR-2 staðsett á yfirborði æðaþelsfrumna. Plgf og VEGF-B bindast aðeins viðtyratýrósín kínasa VEGFR-1, sem auk þess að vera á yfirborði æðaþelsfrumna, er einnig til staðar á yfirborði hvítfrumna. Óhófleg virkjun þessara viðtaka VEGF-A getur leitt til meinafræðilegrar æðaæðar og aukinnar gegndræpi í æðum. Plgf einnig viðeigandi fyrir þróun meinafræðilegs nýræðastíflu og síast æxli með bólgufrumum.
Aflibercept virkar sem leysanleg gildruviðtaka sem binst VEGF-A með meiri skyldleika en innfæddir viðtakar VEGF-Afyrir utan þetta, bindur hann einnig skyld tengda bindla VEGF-B og Plgf. Aflibercept tengist mönnum VEGF-A, VEGF-B og Plgf með myndun stöðugra óvirkra fléttna sem hafa ekki líffræðilega virkni. Starfar sem gildra fyrir bindla, kemur aflibercept í veg fyrir bindingu innrænna bindla við samsvarandi viðtaka þeirra og hindrar þannig sendingu merkja í gegnum þessa viðtaka.
Aflibercept hindrar virkjun viðtaka VEGF og útbreiðsla æðaþelsfrumna og hindrar þannig myndun nýrra skipa sem gefa æxlinum súrefni og næringarefni.
Aflibercept er tengdur VEGF-A manna (jafnvægisdreifingarfasti (Cd) - 0,5 pmól fyrir VEGF-A165 og 0,36 pmól fyrir VEGF-A121), s Plgf manneskja (cd 39 pmol fyrir Plgf-2), s VEGF-B manna (Cd 1,92 pmól) með myndun stöðugrar óvirku fléttu sem hefur ekki líffræðilega virkni sem hægt er að ákvarða.
Notkun aflibercept í músum með xenograft eða æxli í græðlingum hindraði vöxt ýmissa tegunda kirtilkrabbameina.
Hjá sjúklingum með krabbamein í ristli í endaþarmi (MKRP) sem áður hafa verið meðhöndlaðir með lyfjameðferð sem inniheldur oxaliplatin (með eða án fyrri gjöf bevacizumab), var lyfjameðferðin Zaltrap ® /FOLFIRI (fluorouracil, irinotecan, kalsíumfolinat) sýndi tölfræðilega marktæka aukningu á lífslíkum samanborið við lyfjameðferð FOLFIRI.
Lyfjahvörf
Frásog Í forklínískum rannsóknum, sem gerðar voru á æxlislíkönum, voru líffræðilega virkir skammtar af aflibercept samsvaraðir þeim skömmtum sem nauðsynlegar voru til að búa til styrk frjálsa aflibercept í blóðrásinni, umfram styrk aflibercept sem streymir í altæka blóðrásinni í tengslum við VEGF. Styrkur í blóðrásinni í tengslum við VEGF aflibercepta með aukningu á skammti hans eykst þar til mest VEGF ekki verið tengdur.Frekari hækkun á skammti aflibercept leiðir til skammtaháðrar aukningar á styrk óbundins aflibercept í blóðrásinni og aðeins til lítilsháttar aukningar á styrk sem tengist VEGF aflibercepta.
Hjá sjúklingum er Zaltrap gefið í 4 mg / kg iv skömmtum á tveggja vikna fresti, þar sem umfram styrk þéttni aflibercept í blóðrás er umfram styrk aflibercept í tengslum við VEGF.
Við ráðlagðan skammt, 4 mg / kg einu sinni á tveggja vikna fresti, er styrkur frjálsa aflibercept nálægt gildi Css náðist á annarri meðferðarlotunni með nánast engri uppsöfnun (uppsöfnunstuðull 1,2 í jafnvægi, samanborið við styrk ókeypis aflibercept við fyrstu inndælingu).
Dreifing. Vss ókeypis aflibercepta er 8 lítrar.
Umbrot. Þar sem aflibercept er prótein hafa rannsóknir á umbrotum þess ekki verið gerðar. Búist er við að Aflibercept muni brotna niður í lítil peptíð og stakar amínósýrur.
Brotthvarf. Ókeypis aflibercept sem er í blóðrásinni er aðallega tengt VEGF- fjölskylda með myndun stöðugra óvirkra fléttna. Þess er vænst að eins og önnur stór prótein í tengslum við VEGF og frjáls aflibercept verður smám saman eytt úr kerfisrásinni með öðrum líffræðilegum aðferðum, svo sem proteolytic catabolism.
Við skammta sem voru yfir 2 mg / kg var úthreinsun frjálsa aflibercept 1 l / dag með loka T1/2 6 dagar
Prótein með mikla mólþunga skiljast ekki út um nýru og því er búist við að útskilnaður aflibercept um nýru sé í lágmarki.
Línuleiki / ólínuleiki brotthvarfs. Í tengslum við markbindingu aflibercept við mark sitt (innræn VEGF) frjáls aflibercept í skömmtum undir 2 mg / kg sýndi snarlega (ólínulegan) styrk minnkaðan í altæka blóðrásinni, greinilega tengd bindingu þess með mikla sækni í innræn VEGF. Á skammtabilinu frá 2 til 9 mg / kg verður úthreinsun frjálsa aflibercept línuleg, greinilega vegna ómettaðs líffræðilegs útskilnaðar, svo sem próteinsbrots.
Sérstakir sjúklingahópar
Börn. Með inntöku / inntöku lyfsins Zaltrap ® í skömmtum 2, 2,5, 3 mg / kg á tveggja vikna fresti. 8 börn með fast æxli (á aldrinum 5 til 17 ára), meðaltal T1/2 ókeypis aflibercept, ákvarðað eftir fyrsta skammt, var um það bil 4 dagar (3 til 6 dagar).
Aldraðir sjúklingar. Aldur hefur ekki áhrif á lyfjahvörf aflibercept.
Kyn Þrátt fyrir mismun á úthreinsun frjálsa aflibercept og Vd Hjá körlum og konum kom ekki fram kynbundinn munur á almennri útsetningu þess þegar þeim var gefið í 4 mg / kg skammti.
Líkamsþyngdarstuðull. Líkamsþyngd hafði áhrif á úthreinsun fría aflibercept og Vd Þannig sást aukning á almennri útsetningu aflibercept hjá sjúklingum með meira en 100 kg líkamsþyngd um 29%.
Kynþáttaaðild. Kynþáttahatur og þjóðerni höfðu ekki áhrif á lyfjahvörf aflibercept.
Lifrarbilun. Formlegar rannsóknir á notkun Zaltrap hjá sjúklingum með lifrarbilun hafa ekki verið gerðar.
Hjá sjúklingum með vægan (heildarstyrk bilirubins í blóði ≤1,5 VGN við hvaða virkni gildi sem er fyrir ACT) og miðlungs (heildar styrkur bilirubins í blóði> 1,5–3 VGN við hvaða virkni gildi sem var fyrir ACT), sýndi lifrarbilun enga breytingu á úthreinsun að frádráttarlausu . Engar upplýsingar liggja fyrir um lyfjahvörf aflibercept hjá sjúklingum með verulega skerta lifrarstarfsemi (styrkur heildar bilirubins í blóði> 3 VGN við neitt ACT virkni gildi).
Nýrnabilun. Formlegar rannsóknir á notkun Zaltrap hjá sjúklingum með nýrnabilun hafa ekki verið gerðar.
Enginn munur fannst á altækri útsetningu (AUC) ókeypis aflibercept hjá sjúklingum með nýrnabilun af ýmsum alvarleikastigum þegar Zaltrap var notað í 4 mg / kg skammti.
Meðganga og brjóstagjöf
Engar upplýsingar liggja fyrir um notkun aflibercept á meðgöngu. Rannsóknir á dýrum hafa leitt í ljós eituráhrif á fósturvísi og vansköpun hjá aflibercept. Þar sem æðamyndun skiptir miklu máli fyrir þróun fósturvísanna, getur hömlun á æðamyndun með gjöf Zaltrap ® valdið skaðlegum áhrifum á þungun. Ekki er mælt með notkun Zaltrap á meðgöngu og hjá konum sem geta verið þunguð.
Ráðleggja ætti konum á barneignaraldri að forðast þungun meðan á meðferð með Zaltrap stendur og þeim skal tilkynnt um möguleikann á aukaverkunum Zaltrap ® á fóstrið.
Konur á barneignaraldri og frjósömir karlar ættu að nota öruggar getnaðarvarnir meðan á meðferð stendur og í að minnsta kosti 6 mánuði eftir síðasta skammt meðferðar.
Möguleiki er á skertri frjósemi hjá körlum og konum meðan á meðferð með aflibercept stendur (byggt á gögnum sem fengust í rannsóknum á öpum, hjá körlum og konum þar sem aflibercept olli skertri frjósemi, alveg afturkræf eftir 8-18 vikur).
Klínískar rannsóknir til að meta áhrif Zaltrap ® á framleiðslu brjóstamjólkur, losun aflibercept í brjóstamjólk og áhrif þess á ungbörn hafa ekki verið framkvæmd.
Ekki er vitað hvort aflibercept skilst út í brjóstamjólk. Hins vegar, vegna þess að ómögulegt er að útiloka möguleika á aflibercept skarpskyggni í brjóstamjólk, svo og möguleika á að fá alvarlegar aukaverkanir af völdum aflibercept hjá ungbörnum, er nauðsynlegt annað hvort að neita að hafa barn á brjósti eða ekki nota Zaltrap ® (fer eftir mikilvægi þess að nota lyfið fyrir móðurina).
Aukaverkanir
Algengustu aukaverkanirnar (HP) (af öllum alvarleikastigum, tíðni ≥20%), komu fram að minnsta kosti 2% oftar þegar krabbameinslyfjameðferð Zaltrap® /FOLFIRIen með lyfjameðferð FOLFIRIvoru eftirfarandi HP (í röð eftir minnkandi tíðni): hvítfrumnafæð, niðurgangur, daufkyrningafæð, próteinmigu, aukin virkni ACT, munnbólga, þreyta, blóðflagnafæð, aukin ALT virkni, aukinn blóðþrýstingur, minnkuð líkamsþyngd, minnkuð matarlyst, nefblæðingar, kviðverkir, meltingartruflanir, aukinn þéttni kreatíníns í sermi og höfuðverkur.
Algengasta HP með 3-4 gráðu alvarleika (með tíðni ≥5%), sást að minnsta kosti 2% oftar þegar krabbameinslyfjameðferð Zaltrap® /FOLFIRI borið saman við lyfjameðferð FOLFIRIvoru eftirfarandi HP (í minnkandi röð atriða): daufkyrningafæð, niðurgangur, hækkaður blóðþrýstingur, hvítfrumnafæð, munnbólga, þreyta, próteinmigu og þróttleysi.
Almennt sást að meðferð var hætt vegna aukaverkana (af öllum alvarleikastigum) hjá 26,8% sjúklinga sem fengu lyfjameðferð með Zaltrap ® /FOLFIRIsamanborið við 12,1% sjúklinga sem fengu krabbameinslyfjameðferð FOLFIRI. Algengasta HP sem þjónaði sem ástæðan fyrir því að synja meðferð hjá ≥1% sjúklinga sem fengu lyfjameðferð með Zaltrap ® /FOLFIRIvoru: þróttleysi / þreyta, sýkingar, niðurgangur, ofþornun, hækkaður blóðþrýstingur, munnbólga, bláæðasegareks fylgikvillar, daufkyrningafæð og próteinmigu.
Skammtaaðlögun lyfsins Zaltrap ® (minnkun skammta og / eða aðgerðaleysi) var framkvæmd í 16,7%. Frestun síðari meðferðarlotna yfir 7 daga sást hjá 59,7% sjúklinga sem fengu lyfjameðferð með Zaltrap ® /FOLFIRIsamanborið við 42,6% sjúklinga sem fengu lyfjameðferð FOLFIRI.
Dauði af öðrum orsökum, auk sjúkdómsþróunar, sem kom fram innan 30 daga frá síðustu lotu rannsóknarinnar á lyfjameðferð, var skráð hjá 2,6% sjúklinga sem fengu lyfjameðferð Zaltrap ® /FOLFIRIog hjá 1% sjúklinga sem fengu lyfjameðferð FOLFIRI. Dánarorsök sjúklinga sem fá krabbameinslyfjameðferð Zaltra ® /FOLFIRIvoru: sýking (þ.mt daufkyrningafæð (sermis daufkyrningafæð) hjá 4 sjúklingum, ofþornun hjá 2 sjúklingum, blóðþurrð í 1 sjúklingi, umbrotsheilkenni í 1 sjúklingi, öndunarfærasjúkdómur (bráður öndunarbilun, lungnabólga í öndun og lungnasegarek) hjá 3 sjúklingum sjúklingar, truflanir í meltingarvegi (blæðing frá skeifugörn í skeifugörn, bólga í meltingarvegi, fullkomin þörmun í þörmum) hjá 3 sjúklingum, dauði af óþekktum orsökum hjá 2 sjúklingum.
Hér að neðan eru HP og frávik rannsóknarstofuþátta sem sjást hjá sjúklingum sem fengu lyfjameðferð Zaltrap ® /FOLFIRI með skiptingu þeirra í kerfislíffæraflokka í samræmi við flokkun læknishandbókarinnar vegna eftirlitsstarfsemi MedDRA.
HPs sem kynnt voru hér að neðan voru skilgreind sem öll óæskileg klínísk viðbrögð eða frávik í rannsóknarstofuþáttum með ≥2% hærri tíðni (fyrir HP af öllum alvarleikastigum) í aflibercept hópnum samanborið við lyfleysuhópinn í rannsókn sem gerð var á sjúklingum með ICP. HP styrkleiki var flokkaður samkvæmt NCI CTC (Sameiginleg skilyrði fyrir krabbameinastofnunAlþjóðlega krabbameinsstofnunin (General Cancer Institute Scale) mælikvarði) útgáfa 3.0.
Tíðni HP var ákvörðuð í samræmi við WHO flokkunina á eftirfarandi hátt: mjög oft - ≥10%, oft - ≥1– þ.m.t. ≥3 alvarleiki).
Af hálfu blóðsins og eitlar: mjög oft - hvítfrumnafæð (af öllum alvarleikastigum, þar með talið ≥ 3. stigs alvarleika), daufkyrningafæð (af öllum alvarleikastigum, þar með talið ≥ 3. stigs alvarleika), blóðflagnafæð (öll stig af alvarleika), oft - daufkyrningafæð með hita (af öllum alvarleikastigum, þ.mt ≥3 stigi alvarleika), blóðflagnafæð (≥3 stig af alvarleika).
Frá ónæmiskerfinu: oft - ofnæmisviðbrögð (öll stig af alvarleika), sjaldan - Ofnæmisviðbrögð (≥ 3. alvarleiki).
Efnaskipta- og næringarraskanir: mjög oft - minnkuð matarlyst (öll stig af alvarleika), oft - ofþornun (öll stig alvarleika og ≥ 3 stig af alvarleika), minnkuð matarlyst (≥ 3 stig af alvarleika).
Úr taugakerfinu: mjög oft - höfuðverkur (af öllum alvarleikastigum), oft - höfuðverkur (≥3 stigs alvarleika), sjaldan - POPs.
Úr skipunum: mjög oft - hækkun á blóðþrýstingi (af öllum alvarleikastigum) (hjá 54% sjúklinga sem höfðu hækkað blóðþrýsting (≥3 stig af alvarleika), hækkun á blóðþrýstingi sem þróaðist í fyrstu tveimur meðferðarlotunum), blæðingar / blæðingar (af öllum stigum alvarleika), Algengasta blæðingin var minniháttar blæðingar í nefi (1-2 alvarleiki), oft fylgikvillar í segarek í slagæðum (ATEO) (svo sem bráð slys í heilaæðum, þar með talin tímabundin blóðþurrð í heilaæðum, hjartaöng, hjartaöng ombus, hjartadrep, segarek í slagæðum og ristilbólga í blóðþurrð (öll alvarleg stig), bláæðasegareks fylgikvillar (segamyndun í djúpum bláæðum og lungnasegarek) af öllum alvarleika, blæðingum (≥3 stigi alvarleika, stundum banvæn), þ.mt meltingarvegi - blæðingar í þörmum, hematuria, blæðingar eftir læknisaðgerðir, tíðni er óþekkt - hjá sjúklingum sem fengu Zaltrap ® var greint frá þróun alvarlegrar blæðingar innan höfuðkúpu og lungnablæðingar / blóðskilun, þ.e.a.s. . banvæn.
Frá öndunarfærum, brjósti og miðmæti: mjög oft - mæði (af öllum alvarleikastigum), nefblæðingar (af öllum alvarleikastigum), meltingartruflanir (af öllum alvarleikastigum), oft - verkir í meltingarvegi (allt stigs alvarleika), nefslímur (nefslímur af aðeins 1-2 alvarleika) , sjaldan - mæði (≥3 stig af alvarleika), blæðingar í nefi (≥3 stig af alvarleika), meltingartruflanir (≥ 3 stig af alvarleika), verkir í meltingarvegi (≥ 3 stig af alvarleika).
Frá meltingarvegi: mjög oft - niðurgangur (af öllum alvarleikastigum, þar með talið ≥ 3. alvarleiki), munnbólga (af öllum alvarleikastigum, þar með talin ≥3. alvarleiki), kviðverkir (af öllum stigum alvarleika), verkir í efri hluta kviðarhols (öll alvarleg stig), oft - kviðverkir ≥3 stigs alvarleika, verkir í efri hluta kviðarhols (≥3 stigs alvarleika), gyllinæð (öll stig af alvarleika), blæðing frá endaþarmi (öll stig af alvarleika) , verkir í endaþarmi (öll stig af alvarleika), tannverkur (allar gráður af alvarleika), aphthous munnbólga (öll stig af alvarleika), myndir fistúlur (endaþarms, smáþörmum-þvagfærum, ytri smáþörmum (smáþörmahúð), stórum þörmum og leggöngum, milliverk) (sjaldan og alvarleg), sjaldan - myndun fistúla í meltingarvegi (≥3 stigs alvarleika), rof á veggjum meltingarvegsins (allt alvarleika, þ.mt ≥3 stig af alvarleika), þ.mt banvæn göt á veggjum meltingarvegar, blæðingar frá endaþarmi (≥ 3 stig af alvarleika), aphthous munnbólga (≥ 3 stig af alvarleika), verkur í endaþarmi ( ≥3 alvarleiki).
Af húðinni og undirhúðinni: mjög oft - lófa-plantar rauðkornaheilkenni (öll alvarleika), oft - oflitun húðar (öll alvarleg stig), palmar-plantar rauðkornaheilkenni heilkenni (≥ 3. alvarleiki).
Frá nýrum og þvagfærum: mjög oft - próteinmigu (samkvæmt sameinuðum klínískum rannsóknum og rannsóknarstofuupplýsingum) (öll stig af alvarleika), aukning á styrk kreatíníns í sermi (öll stig af alvarleika), oft - próteinmigu (≥3 stig af alvarleika), sjaldan - nýrungaheilkenni. Einn sjúklingur með próteinmigu og hækkaðan blóðþrýsting hjá 611 sjúklingum sem fengu meðferð með krabbameinslyfjameðferð Zaltrap ® /FOLFIRI, greindist með segamyndun í æðamyndun.
Almennar aukaverkanir og viðbrögð á stungustað: mjög oft - þróttleysi (öll alvarleikastig), þreytutilfinning (öll alvarleikastig, þar með talið ≥3 stig af alvarleika), oft - þróttleysi (≥3 stig af alvarleika), sjaldan - skert sár gróa ( misræmi í jöðrum sársins, bilun í anastomoses) (öll stig af alvarleika, þar með talið ≥ 3 stig af alvarleika).
Rannsóknar- og hjálpartæki gögn: mjög oft - aukin virkni ACT, ALT (öll stig af alvarleika), minnkuð líkamsþyngd (öll stig alvarleika), oft - aukin virkni ACT, ALT (≥ 3. stigs alvarleika), minnkuð líkamsþyngd (≥ 3. stig alvarleika) .
Tíðni HP í sérstökum sjúklingahópum
Aldur. Hjá öldruðum sjúklingum (≥ 65 ára) var tíðni niðurgangs, svima, þróttleysis, þyngdartaps og ofþornunar meira en 5% hærri en hjá sjúklingum á yngri aldri. Fylgjast skal náið með öldruðum sjúklingum með tilliti til niðurgangs og / eða hugsanlegrar ofþornunar.
Nýrnabilun. Hjá sjúklingum með væga skerðingu á nýrnastarfsemi þegar byrjað var að nota Zaltrap ® var tíðni HP sambærileg og hjá sjúklingum án skertrar nýrnastarfsemi þegar byrjað var að nota Zaltrap ®. Hjá sjúklingum með í meðallagi og alvarlega skerta nýrnastarfsemi var tíðni HP utan nýrna almennt sambærileg og hjá sjúklingum án nýrnabilunar, að undanskildum> 10% umfram ofþornunartíðni (öll stig af alvarleika).
Ónæmingargeta Eins og öll önnur próteinlyf, hefur aflibercept hugsanlega hættu á ónæmingargetu.Almennt, samkvæmt niðurstöðum allra klínískra rannsókna á krabbameinslækningum, sýndi enginn sjúklinganna mikla títra af mótefnum gegn aflibercept.
Notkun lyfsins eftir markaðssetningu
Frá hjartanu: tíðni óþekkt - hjartabilun, minnkað útkast brot á vinstri slegli.
Frá hlið stoðkerfis og stoðvefs: tíðni óþekkt - beindrep í kjálka. Hjá sjúklingum sem taka aflibercept hefur verið greint frá tilfelli beinþynningar í kjálka, sérstaklega hjá þeim sjúklingum sem eru með ákveðna áhættuþætti fyrir beinþynningu í kjálka, svo sem notkun bisfosfónats og / eða ífarandi tannaðgerðir.
Skammtar og lyfjagjöf
Ív, í formi 1 klst. innrennslis og síðan komið á lyfjameðferð FOLFIRI. Ráðlagður skammtur af Zaltrap ®, notaður í samsettri meðferð með lyfjameðferð FOLFIRIer 4 mg / kg.
Krabbameinslyfjameðferð FOLFIRI
Á fyrsta degi hringrásarinnar - samtímis innrennsli í bláæð í gegnum Y-laga legginn af irinotecan í skammtinum 180 mg / m 2 í 90 mínútur og kalsíumfolínat (vinstri og hægri hönd racemates) í 400 mg / m 2 skammti í 2 klst. í kjölfarið gjöf flúoróúrasíls í bláæð (bolus) í 400 mg / m 2 skammti og síðan samfellt innrennsli í bláæð af flúoróúrasíli í 2400 mg / m 2 skammti í 46 klukkustundir
Lyfjameðferðarlotur eru endurteknar á tveggja vikna fresti.
Meðferð með Zaltrap ætti að halda áfram þar til versnun sjúkdóms eða þróun óviðunandi eiturverkana.
Ráðleggingar um leiðréttingu á skammtaáætlun / seinkun meðferðar
Hætta skal meðferð með Zaltrap ® í eftirfarandi tilvikum:
- þróun alvarlegra blæðinga,
- þróun götunar á veggjum meltingarvegsins,
- þróun háþrýstingskreppu eða heilakvilla vegna háþrýstings,
- þróun fylgikvilla í segarek í slagæðum,
- þróun nýrungaheilkenni eða segamyndun í æðamyndun.
- þróun alvarlegra ofnæmisviðbragða (þ.mt berkjukrampa, mæði, ofsabjúgur, bráðaofnæmi),
- brot á sárabótum sem krefjast læknisaðgerða,
- þróun afturkræfs posterior heilakvillaheilkennis (POPs), einnig þekktur sem afturkræfur bakkakvöðvakvilli (POP).
Að minnsta kosti 4 vikum fyrir áætlaða aðgerð ætti að hætta meðferð með Zaltrap ® tímabundið.
| Seinkun lyfjameðferðar Zaltrap ® / FOLFIRI | |
| Daufkyrningafæð eða blóðflagnafæð | Notkun krabbameinslyfjameðferðarinnar Zaltrap ® /FOLFIRI fresta skal þar til fjöldi daufkyrninga í útlæga blóði eykst í ≥1,5 · 10 9 / l og / eða fjöldi blóðflagna í útlæga blóði eykst ekki til ≥ 75 · 10 9 / l |
| Væg eða í meðallagi ofnæmisviðbrögð (þ.mt roði í húð, útbrot, ofsakláði og kláði) | Stöðva ætti meðferð tímabundið þar til viðbrögðin hætta. Ef nauðsyn krefur, til að stöðva ofnæmisviðbrögðin, er mögulegt að nota GCS og / eða andhistamín. Í síðari lotum geturðu haft í huga forvígingu GCS og / eða andhistamína |
| Alvarleg ofnæmisviðbrögð (þ.mt berkjukrampar, mæði, ofsabjúgur og bráðaofnæmi) | Hætta skal krabbameinslyfjameðferð Zaltrap ® /FOLFIRI og framkvæma meðferð sem miðar að því að stöðva ofnæmisviðbrögðin |
| Frestun meðferðar með Zaltrap og aðlögun skammta | |
| Hækkun á blóðþrýstingi | Nauðsynlegt er að stöðva notkun lyfsins Zaltrap tímabundið þar til stjórn á hækkun blóðþrýstings næst. Með endurtekinni þróun verulegs hækkunar á blóðþrýstingi ætti að stöðva notkun lyfsins þar til stjórn á hækkun blóðþrýstings næst og í síðari lotum minnka skammt Zaltrap ® í 2 mg / kg |
| Próteinmigu (sjá „Sérstakar leiðbeiningar“) | Stöðva notkun Zaltrap fyrir próteinmigu ≥ 2 g / dag, hægt er að hefja meðferð aftur eftir að próteinmigu lækkar í ® þar til próteinmigu minnkar |
| Alvarleg munnbólga og palmar-plantar erythrodysesthesia heilkenni | Draga ætti úr bolus og innrennslisskammti af flúoróúrasíli um 20% |
| Alvarlegur niðurgangur | Minnka ætti skammtinn af irinotecan um 15-20%. Ef alvarlegur niðurgangur myndast hvað eftir annað ætti næsta lota að minnka bolus og innrennslisskammt af flúoróúrasíli um 20%. Ef alvarlegur niðurgangur er viðvarandi með minni skömmtum af báðum lyfjunum, skal hætta notkun FOLFIRI. Ef nauðsyn krefur er hægt að meðhöndla með lyfjum gegn meltingarfærum og endurnýja tap á vökva og salta. |
| Hnoð daufkyrningafæð og daufkyrningafæð | Í síðari lotum ætti að minnka skammtinn af irinotecan um 15-20%. Með endurteknum þroska í síðari lotum ætti að minnka bolus og innrennslisskammt af flúoróúrasíli um 20%. Hugsanlegt er að beita G-CSF. |
Fyrir frekari upplýsingar um eiturhrif irinotecans, flúoróúrasíls og kalsíumfolínats, sjá leiðbeiningar um notkun þeirra.
Sérstakir sjúklingahópar
Börn. Öryggi og verkun hjá börnum hefur ekki verið staðfest.
Í öryggis- og þolrannsókn með skammtahækkun fengu 21 sjúklingur á aldrinum 2 til 21 árs (meðalaldur 12,9 ár) með fast æxli Zaltrap ® í skömmtum 2 til 3 mg / kg iv á tveggja vikna fresti. Lyfjahvarfabreytur frjálsa aflibercept voru metnar hjá 8 þessara sjúklinga (á aldrinum 5 til 17 ára), sjá lyfjahvörf, undirkafli „Sérstakir sjúklingahópar“. Hámarks þolaði skammtur í rannsókninni var 2,5 mg / kg skammtur, sem var lægri en öruggur og virkur skammtur fyrir fullorðna með krabbamein í ristli og endaþarmi.
Aldraðir sjúklingar. Aldraðir sjúklingar þurfa ekki skammtaaðlögun Zaltrap ®.
Lifrarbilun. Formlegar rannsóknir á notkun Zaltrap hjá sjúklingum með lifrarbilun hafa ekki verið gerðar. Byggt á klínískum upplýsingum var altæk útsetning aflibercept hjá sjúklingum með væga til miðlungsmikla lifrarbilun svipuð og hjá sjúklingum með eðlilega lifrarstarfsemi.
Klínískar upplýsingar benda til þess að ekki sé þörf á aðlögun skammta aflibercept hjá sjúklingum með væga til miðlungsmikla lifrarbilun.
Engar upplýsingar liggja fyrir um notkun aflibercept hjá sjúklingum með verulega skerta lifrarstarfsemi.
Nýrnabilun. Formlegar rannsóknir á notkun Zaltrap hjá sjúklingum með skerta nýrnastarfsemi hafa ekki verið gerðar. Byggt á klínískum gögnum var altæk útsetning aflibercept hjá sjúklingum með væga til miðlungsmikla nýrnabilun svipuð og hjá sjúklingum með eðlilega nýrnastarfsemi.
Klínískar sannanir benda til þess að ekki sé þörf á leiðréttingu upphafsskammts aflibercept hjá sjúklingum með vægt til í meðallagi nýrnabilun. Örfá gögn liggja fyrir um notkun lyfsins hjá sjúklingum með alvarlega nýrnabilun og því skal gæta varúðar við notkun lyfsins hjá slíkum sjúklingum.
Tillögur um undirbúning lausna og kynningu þeirra
Nota skal lyfið undir eftirliti læknis með reynslu af notkun átakslyfja.
Sprautið ekki óþynnt þykkni. Sprautið ekki iv í þota (hvorki hratt né hægt).
Zaltrap er ekki ætlað til gjafar í glerhlaup.
Eins og á við um allar efnablöndur utan meltingarvegar, skal skoða þynntu lausnina af Zaltrap ® sjónrænt með tilliti til óuppleystra agna eða aflitunar.
Nota skal þynnt Zaltrap ® lausnir með IV innrennslissettum úr PVC sem inniheldur díetýlhexýlþalat (DEHP), PVC sem inniheldur ekki DEHP, en inniheldur tríóktýltrímellat (TOTM), pólýprópýlen, PE, húðuð í PVC, pólýúretan.
Innrennslissettir til innrennslis ætti að innihalda pólýetersúlfónsíur með 0,2 míkron holuþvermál. Ekki nota pólývínýliden flúoríð (PVDF) eða nylon síur.
Vegna skorts á rannsóknum á eindrægni ætti ekki að blanda Zaltrap ® við önnur lyf eða leysiefni, að undanskildum 0,9% natríumklóríðlausn og 5% dextrósa lausn.
Undirbúningur innrennslislausnarinnar og meðhöndlun
Innrennslislausn lyfsins Zaltrap ® ætti að undirbúa af lækni við smitgát í samræmi við örugga meðhöndlun.
Ekki nota flöskuna með lyfinu ef lausn þykknisins inniheldur óuppleystar agnir eða breyting er á lit þess.
Nota skal innrennslisílát úr PVC sem inniheldur DEHP eða polyolefin (án PVC og DEHF).
Aðeins til innrennslis í bláæð vegna ofmörkunar (1000 mosmól / kg) af Zaltrap ® þykkni.
Lyfið er ekki ætlað til inndælingar í glöskennda líkamann.
Þynna þarf þykkni lyfsins Zaltrap ®. Fjarlægðu nauðsynlega magn af Zaltrap ® þykkni og þynntu að nauðsynlegu magni með 0,9% natríumklóríð stungulyfi, lausn eða 5% dextrósa stungulyfi, lausn.
Styrkur aflibercept í innrennslislausninni eftir þynningu á þykkni Zaltrap ® ætti að vera á bilinu 0,6–8 mg / ml.
Frá örverufræðilegu sjónarmiði á að nota þynntu lausnina af Zaltrap ® strax, eðlisfræðilegum og efnafræðilegum stöðugleika þess er haldið í allt að 24 klukkustundir við hitastigið 2-8 ° C og allt að 8 klukkustundir við hitastigið 25 ° C.
Hettuglös með lyfinu Zaltrap eru ætluð til einnota. Farga skal öllum ónotuðum lyfjum sem eru eftir í hettuglasinu í samræmi við viðeigandi rússneskar kröfur. Ekki stinga í hettuglasið aftur eftir að nálinni hefur þegar verið sett í það.
Ofskömmtun
Engar upplýsingar eru fyrirliggjandi um öryggi þess að taka Zaltrap í skömmtum sem eru stærri en 7 mg / kg einu sinni á tveggja vikna fresti eða 9 mg / kg einu sinni á þriggja vikna fresti.
Einkenni algengasta HP sem sést hefur með þessum skömmtum var svipað og HP sem sást við lyfið í meðferðarskömmtum.
Meðferð: viðhaldsmeðferð er nauðsynleg, einkum eftirlit og meðhöndlun á hækkuðum blóðþrýstingi og próteinmigu. Það er ekkert sérstakt mótefni gegn Zaltrap ®. Sjúklingurinn ætti að vera undir nánu eftirliti læknis til að bera kennsl á og hafa eftirlit með öllum HP sem lýst er í kaflanum „Aukaverkanir“.
Slepptu formi
Þykkni, innrennslislyf, lausn, 25 mg / ml. 4 ml af lyfinu í flösku af litlausu gleri (gerð I), korkaður með brómóbútýl gúmmítappa með álprufuhettu með stallhring og þéttiskífu. 1 eða 3 fl. í pappaknippu. 8 ml af lyfinu í flösku af litlausu gleri (gerð I), korkaður með tappa úr brómóbútýlgúmmíi með álprufuhettu með stallhring og þéttiskífu. 1 fl. í pappaknippu.
Leiðbeiningar um notkun Zaltrap
Virkt efni: aflibercept 25 mg
Hjálparefni: natríumfosfat einhýdrat (E339), natríum vetnisfosfat heptahýdrat (E339), sítrónusýru einhýdrat (E330), natríumsítrat tvíhýdrat (E331), kornað natríumklóríð, súkrósi, pólýsorbat 20 (E433), saltsýra 36% (E507), natríumhýdroxíð (E524), vatn fyrir stungulyf.
Lýsing Gegnsætt litlaus eða fölgul vökvi, laus við vélræn óhreinindi.
Lyfjalýsing

Lyfið tilheyrir þeim hópi sem er notað gegn eiturlyfjum. Það er framleitt í formi þykknis, sem innrennslislausnir eru búnar til. Alþjóðlega óeignarheitið er aflibercept. Vörunöfnin eru Zaltrap og Eilea.
Ábendingar til notkunar
Á sama tíma er tekinn ákveðinn skammtur af fólínsýru, irinotecan og fluorouracil. Allir þessir þættir eru notaðir til lyfjameðferðar hjá sjúklingum sem þjást af krabbameini í ristli og endaþarmi, þegar það sýnir mikla ónæmi gegn öðrum eiturlyfjum. Einnig er „Zaltrap“ notað við bakslag.

Lyfjafræðileg verkun aflibercept
Undir áhrifum aflibercept hætta viðtaka sem veita myndun nýrra æðar til næringar og auka æxlisvöxt. Vegna þess að ekki nóg blóð rennur minnkar æxlið smám saman að stærð, óhefðbundnar frumur hætta að skipta sér og vaxa.

Upplýsingar um hvernig umbrot aflibercept próteins eiga sér stað eru ekki fáanlegar. Vísindamenn benda til þess að það klofni í amínósýrur og peptíð. Virki efnisþátturinn skilst út úr líkamanum í sex daga með hægðum. Nýru taka ekki þátt í því að taka fé.
Notkunarleiðbeiningar "Zaltrap"
Lyfinu er sprautað í bláæð í klukkutíma. Skammtar eru reiknaðir við 4 mg á hvert kíló af líkamsþyngd. Lyfjameðferðin er eftirfarandi:
- Á fyrsta degi meðferðar er notaður Y-laga leggur, með hjálp innrennslis í bláæð eru framkvæmd í samsettri meðferð með irinotecan í magni 180 mg á fermetra. Aðgerðin varir í 90 mínútur. Kalsíumfolínat er gefið í tvær klukkustundir í 400 mg skammti og sama magn af flúoróúrasíli,
- Næsta innrennsli verður samfellt í 46 klukkustundir. Í þessu tilfelli er fluorouracil gefið í 2400 mg skammti.
Þessi meðferðarlotu er endurtekin á tveggja vikna fresti. Fyrir fólk með sykursýki þarf ekki að breyta skömmtum.
Innrennsli ætti að framkvæma af lækni sem hefur reynslu af lyfjameðferð.

Í óþynntu formi og með þota, á ekki að gefa lyfið í neinum tilvikum.
Fyrir notkun er lausnin vandlega skoðuð. Það ætti að hafa viðeigandi útlit án óleystra agna.
Ekki nota nylon eða pólývínýliden flúoríðsíur við innrennsli.
Þar sem engar upplýsingar eru um samsetningu lyfsins við önnur lyf er aðeins leyfð samsetning efnisins og natríumklóríðlausn eða dextrósa.
Aðeins læknir ætti að útbúa lausn fyrir gjöf í bláæð og fylgjast með reglum um asepsis. Ekki nota flösku sem inniheldur óuppleystar agnir eða litur lyfsins hefur breyst. Eftir þynningu ætti styrkur aflibercept að vera á bilinu 0,6–8 mg / ml. Nauðsynlegt er að nota fullunna lyfið strax þar sem einungis er hægt að varðveita eðlis- og efnafræðilegan stöðugleika á daginn.
Hvar er betra að kaupa „Zaltrap“, verð þess og geymslu
Þú getur keypt lyf í apóteki. Til að gera þetta þarftu að gefa lyfseðil læknis. Án þess er sala lyfsins undanskilin. Kostnaður við flösku af lyfi er frá 8500 rúblur.

Lyfið ætti að vera í herbergi þar sem hitastigið er ekki hærra en 8 og ekki lægra en 2 gráður. Lyfið ætti ekki að verða fyrir beinu sólarljósi.
Þú getur geymt lyfið í þrjú ár frá framleiðsludegi. Eftir að þessu tímabili lýkur geturðu ekki notað lyfið og því verður að farga því.
Umsagnir um "Zaltrap"
„Saltrap“ kom fram við föður minn. Þetta er gott lyf, það virkar á áhrifaríkan hátt gegn æxlinu en aukaverkanir koma alltaf fram. Það er gott að þeir sprauta það á tveggja vikna fresti, því faðirinn átti mjög erfitt með að þola lyfjameðferð. En greiningar sýndu að æxlið fer minnkandi.
Eftir kynningu á Zaltrap þá verkaði höfuðið stöðugt, það var ógleði og uppköst, mig langaði stöðugt að sofa. En lyfið hefur áhrif á æxlið mjög fljótt. Þess vegna, til að fá góðan árangur, getur þú þolað.
Þrátt fyrir að lyfið sé nokkuð dýrt og ástandið eftir það er hræðilegt, en það hjálpar virkilega. Með hjálp nokkurra námskeiða gat ég nánast losað mig við æxlið. Læknar segja að litlar líkur séu á bakslagi. Fyrir þetta lyf var ég meðhöndluð af öðrum en áhrif þeirra hélst í stuttan tíma. Eftir Zaltrap hef ég ekki haft nein merki um krabbamein í nokkur ár.
Við munum vera mjög þakklát ef þú metur það og deilir því á samfélagsnetum
Slepptu formum og samsetningu
Innrennslisþykknið sem lausnin er útbúin úr. Hettuglösin eru 4 ml og 8 ml. Magn aðalefnisins aflibercept er 25 mg í 1 ml. Annar kosturinn er tilbúin dauðhreinsuð lausn ætluð til gjafar í bláæð. Litur lausnarinnar er gegnsær eða með fölgulum blæ.
Aðalþátturinn er aflibercept prótein. Hjálparefni: natríumfosfat, sítrónusýra, saltsýra, súkrósa, natríumklóríð, natríumhýdroxíð, vatn.
Aflibercept hindrar vinnu viðtaka, sem bera ábyrgð á myndun nýrra æðar sem fæða æxlið og stuðla að miklum vexti þess. Það sem eftir er án blóðflæðis byrjar æxlið að minnka að stærð. Ferlið við vöxt og skiptingu óhefðbundinna frumna stöðvast.
Aflibercept hindrar virkni viðtaka sem bera ábyrgð á myndun nýrra æðar.
Með umhyggju
Nauðsynlegt er að stöðugt fylgjast með heilsufari hjá sjúklingum með nýrnabilun, slagæðaháþrýsting, kransæðahjartasjúkdóm og fyrstu stig hjartabilunar. Með varúð er lyfinu ávísað fyrir aldraða sjúklinga og með slæmt heilsufar, ef matskvarðinn er ekki hærri en 2 stig.
Hvernig á að taka Zaltrap?
Gjöf í bláæð - innrennsli í 1 klukkustund. Meðalskammtur er 4 mg á hvert kíló af líkamsþyngd. Meðferð er undirrituð á grundvelli krabbameinslyfjameðferðar:
- fyrsta dag meðferðar: innrennsli í bláæð með Y-laga legginn með Irinotecan 180 mg / m² í 90 mínútur, kalsíum fólat í 120 mínútur í 400 mg / m² skammti og 400 mg / m² fluorouracil,
- samfellt innrennsli í viðbót stendur í 46 klukkustundir með skammtinum af Fluorouracil 2400 mg / m².
Gjöf í bláæð - innrennsli í 1 klukkustund.
Hringrás er endurtekin á 14 daga fresti.
Meltingarvegur
Niðurgangur, kviðverkir með mismunandi styrkleika, þróun gyllinæðar, myndun fistúla í endaþarmi, þvagblöðru, smáþörmum. Hugsanlegur tannverkur, munnbólga, eymsli í endaþarmi, leggöngum. Fistlar í meltingarfærum og göt á veggjum koma sjaldan fram, sem geta leitt til dauða sjúklings.
Skaðleg einkenni frá öndunarfærum: mæði kemur oft fyrir.
Frá hjarta- og æðakerfinu
Stekkur í blóðþrýstingi, innri blæðingar. Hjá mörgum sjúklingum: segarek, blóðþurrðarköst, hjartaöng, mikil hætta á hjartadrepi. Í mjög sjaldgæfum tilvikum: opnun blæðingar í kransæðum og blóði, spýting í blóði, miklum blæðingum í meltingarvegi, sem eru dánarorsökin.
Áhrif á getu til að stjórna kerfum
Engin gögn eru til um rannsókn á hugsanlegum áhrifum lyfsins á athyglisstyrk. Mælt er með því að forðast akstur og vinnu með flóknum aðferðum ef sjúklingur hefur aukaverkanir af miðtaugakerfinu, geðhreyfingartruflunum.
Fyrir nýja meðferðarlotu (á 14 daga fresti) ætti að framkvæma blóðrannsókn.
Fyrir nýja meðferðarlotu (á 14 daga fresti) ætti að framkvæma blóðrannsókn. Lyfið er aðeins gefið á sjúkrahúsi til að bregðast tímanlega við merkjum um ofþornun, götun veggja meltingarvegar.
Sjúklingar með almenna heilsufarsvísitölu sem eru 2 stig eða hærri, eru í hættu á aukaverkunum. Þeir þurfa stöðugt lækniseftirlit fyrir tímanlega greiningu á versnandi heilsu.
Myndun fistúla óháð staðsetningu þeirra er vísbending um að meðferð ljúki strax. Óheimilt er að nota lyfin við meðferð sjúklinga sem hafa farið í umfangsmiklar skurðaðgerðir (þar til sár gróa alveg).
Karlar og konur á barneignaraldri verða að nota ýmsar getnaðarvarnir innan sex mánaða (hvorki meira né minna) eftir síðasta skammt af Zaltrap. Undanskilja getnað barns.
Zaltrap lausn er oförvandi. Samsetning þess útilokar notkun lyfja í augnrými. Það er bannað að setja lausnina í glerskólsins.
Notist við elli
Mikil hætta er á að fá langvarandi niðurgang, sundl, hratt þyngdartap og ofþornun hjá sjúklingum á aldrinum 65 ára og eldri. Saltrap meðferð ætti aðeins að fara fram undir eftirliti læknafólks. Við fyrsta merki um niðurgang eða ofþornun þarf strax meðferð við einkennum.
Saltrap meðferð ætti aðeins að fara fram undir eftirliti læknafólks.
Notist á meðgöngu og við brjóstagjöf
Upplýsingar um notkun Zaltrap hjá þunguðum og mjólkandi konum eru ekki tiltækar.
Í ljósi hugsanlegrar hættu á neikvæðum áhrifum á barnið er ekki ávísað lyfjum gegn þessum æxlum fyrir þessa sjúklingahópa.
Upplýsingar um hvort virki hluti lyfsins frásogast í brjóstamjólk eru ekki. Notaðu lyf til meðferðar á krabbameini hjá konum með hjúkrun ef nauðsyn krefur. Brjóstagjöf verður að hætta.
Framleiðandi
Sanofi-Aventis Deutschland GmbH, Þýskalandi.
Lyfjameðferð gegn æxlum
Andoxunaráhrif vítamína
Ksenia, 55 ára, í Moskvu: „Áfanga Zaltrap var ávísað til föður míns til krabbameinsmeðferðar. Lyfið er gott, áhrifaríkt en afar erfitt. Það eru alltaf aukaverkanir. Það er gott að það er gefið aðeins einu sinni á tveggja vikna fresti, því að eftir lyfjameðferð versnaði ástand föðurins alltaf tímabundið, en prófin sýndu jákvæða þróun í að minnka æxli. “
Eugene, 38 ára, Astana: „Ég fann fyrir mörgum aukaverkunum frá Zaltrap. Ástandið var einfaldlega hræðilegt: ógleði, uppköst, stöðugur höfuðverkur, verulegur slappleiki. En lyfið verkar á æxlið fljótt. Áhrif notkunar þess við meðhöndlun krabbameins eru þess virði að lifa alla þessa kvöl. “
Alina, 49 ára, Kemerovo: „Þetta er dýrt lyf og jafnvel ríkið eftir lyfjameðferð með því er þannig að ég vil ekki lifa. En það er áhrifaríkt. Á 1 námskeiði hvarf æxlið mitt næstum því. Læknirinn sagði að líkur væru á bakslagi, en lítið hlutfall. Önnur lyf voru notuð fyrir Zaltrap, en áhrifin voru skammvinn og eftir það hef ég lifað án merkja um krabbamein í 3 ár. “
Zaltrap sprautanlegt

Áður en þú tekur lyfið skaltu segja lækninum frá núverandi lyfjum þínum, fæðubótarefnum (t.d. vítamínum, náttúrulegum fæðubótarefnum o.s.frv.), Ofnæmisviðbrögðum, núverandi sjúkdómum og núverandi heilsufarsástandi (t.d. meðgöngu, komandi aðgerð osfrv.).
Aukaverkanir lyfsins geta verið meira áberandi við ákveðið ástand líkamans. Taktu lyfið samkvæmt fyrirmælum læknisins eða fylgdu leiðbeiningunum um notkun sem fylgir lyfinu. Skammtur lyfsins fer eftir ástandi þínu. Láttu lækninn vita ef engin breyting er á eða ástand þitt versnar.
Mikilvæg atriði sem þú getur rætt við lækninn þinn eru hér að neðan.
- Fylgjast náið með öldruðum sjúklingum vegna niðurgangs og ofþornunar
Finndu út meira: Varúðarráðstafanir og reglur um notkun
Hafðu samband við lækni, lyfjafræðing eða lestu upplýsingarnar á umbúðunum til að fá þessar upplýsingar.
Zaltrap sprautanlegt er fáanlegt í eftirfarandi pakka með eftirfarandi styrkleiki
Laus Zaltrap sprautanleg umbúðir: 4MG
Lyfin eru framleidd af eftirtöldum fyrirtækjum
- Er leyfilegt að nota þunga iðnaðartæki meðan þessi lyf eru tekin? Ef þú finnur fyrir syfju, svima, lágþrýstingi eða höfuðverk meðan þú tekur Zaltrap inndælingar, gætirðu þurft að gefast upp á akstri og stórum iðnaðarbúnaði.
Þú ættir að hætta að keyra ef þú tekur lyfið syfju, sundl eða lágþrýsting. Læknar mæla með því að hætta notkun áfengis með slíkum lyfjum, því áfengi eykur verulega aukaverkanir og syfju. Athugaðu hvort þessi áhrif eru á líkama þinn þegar þú notar Zaltrap inndælingarlyf.
Vertu viss um að ráðfæra þig við lækninn þinn til að fá ráðleggingar með hliðsjón af einkennum líkama þíns og almennri heilsu. Er þetta lyf (vara) ávanabindandi eða ávanabindandi? Flest lyf eru ekki ávanabindandi eða ávanabindandi.
Í flestum tilvikum flokkar ríkið lyf sem geta verið ávanabindandi sem lyf með stýrðri losun. Til dæmis mynd H eða X á Indlandi og línurit II-V í Bandaríkjunum. Vinsamlegast lestu upplýsingarnar á umbúðum lyfsins til að ganga úr skugga um að þetta lyf sé ekki flokkað sem stjórnað.
Að auki skaltu ekki nota lyfið sjálf og ekki venja líkama þinn til lyfja án þess að ráðfæra þig við lækninn. Er mögulegt að hætta að taka það samstundis eða þarf ég að minnka skammtinn smám saman? Stöðva verður sum lyf smám saman vegna bataáhrifa.
Vertu viss um að ráðfæra þig við lækninn þinn til að fá ráðleggingar með hliðsjón af einkennum líkama þíns, almennri heilsu og öðrum lyfjum sem þú tekur.
Ef þú misstir af næsta skammti skaltu taka hann eins fljótt og auðið er. Ef næsta stefnumót er að nálgast geturðu sleppt fyrri stefnumótinu og haldið áfram að fylgja venjulegu lyfjagjafartöflunni. Ekki taka auka skammt til að bæta upp skammt sem gleymdist.
Ef þú lendir í þessum aðstæðum reglulega skaltu íhuga að setja upp áminningar eða biðja fjölskyldu þína að fylgjast með áætluninni.
Vertu viss um að hafa samband við lækninn þinn til að aðlaga áætlunina til að bæta upp fyrir gleymd lyf (ef þú misstir af verulegum fjölda daga).
- Ekki fara yfir ráðlagðan skammt. Óhófleg notkun lyfsins dregur ekki úr ástandi þínu og getur einnig valdið eitrun og alvarlegum aukaverkunum. Ef þú veist um ofskömmtun Zaltrap stungulyf, hafðu samband við neyðarþjónustuna, næsta sjúkrahús eða sjúkrahús.
Vertu viss um að hafa með þér umbúðir, ílát eða nafn lyfsins til að auðvelda greiningu. Ekki senda lyfin til annarra, jafnvel þó þau séu í sama ástandi og þú, eða þér sýnist að aðstæður þínar hafi mörg svipuð einkenni, vegna þess að þetta getur leitt til ofskömmtunar.
- Geymið efnablönduna við stofuhita, á köldum stað og fjarri beinu sólarljósi. Ekki frysta efnablöndur ef slík krafa er ekki sérstaklega kveðið á um í leiðbeiningunum. Geymið lyf fjarri dýrum og börnum.
Ekki skola efnablöndu inn á salerni eða frárennsliskerfi ef það er ekki skýrt tekið fram í leiðbeiningunum. Lyf sem fargað er með þessum hætti geta valdið umtalsverðum skaða á umhverfinu.
Hafðu samband við lækninn þinn til að fá frekari upplýsingar um förgun Zaltrap.
- Jafnvel einn útrunninn Zaltrap skammtur sem hægt er að sprauta getur leitt til alvarlegra afleiðinga. Vertu viss um að ráðfæra þig við lækninn þinn ef þú ert veik / ur eða sár. Að auki, útrunnið lyf getur misst árangur sinn í baráttunni við sjúkdóm þinn.
Til að tryggja þitt eigið öryggi er afar mikilvægt að neita að taka útrunnin lyf.
Ef þú þjáist af sjúkdómi sem þarfnast stöðugra lyfja (hjartasjúkdóma, krampa, lífshættulegra ofnæmisviðbragða) þarftu að koma á áreiðanlegum boðleið með lyfjafyrirtækinu til að hafa stöðugt lager af ferskum lyfjum með venjulegan geymsluþol.
Vinsamlegast hafðu samband við heilbrigðisstarfsmann þinn eða lyfjafræðing og skoðaðu einnig upplýsingarnar á vöruumbúðunum.
- Dailymed LABEL: ZALTRAP-ziv-aflibercept lausn, einbeittu https://dailymed.nlm.nih.gov/dailymed/dr… - Fenginn aðgangur: 12. október 2016.
- NHS val. Hvað ætti ég að gera ef ég sakna skammts af sýklalyfjum? - Fékk aðgang: 14. júlí 2016.
- Hefurðu einhvern tíma saknað skammts af læknisfræðinni þinni? - Fékk aðgang: 3. júlí 2016.
- Krabbamein.Net (2014).
Mikilvægi þess að taka lyfið þitt rétt - Aðgengilegt: 3. júlí 2016.
Gildistími lyfja gildir - meina þeir nokkuð? - Fékk aðgang: 1. maí 2016.
Tilvitnun í stíl Chicago
- „Zaltrap sprautanlegt - notkun, aukaverkanir, dóma, samsetningu, samspil, varúðarráðstafanir, varamenn og skömmtun - Sanofi Aventis Us - TabletWise - USA“ Töfluvís. Opnað fyrir 2. október 2018. https://www.tabletwise.com/us-ru/zaltrap-injectable.
Þessi síða veitir upplýsingar um Zaltrap sprautanlegt á rússnesku.